« Liaison σ » : différence entre les versions
Rédaction. |
|||
| (4 versions intermédiaires par 3 utilisateurs non affichées) | |||
| Ligne 3 : | Ligne 3 : | ||
|——||————————————————||————— |
|——||————————————————||————— |
||
|- |
|- |
||
| valign |
| valign="top" style="font-size:87%" | <br><br>[[Orbitale atomique|Orbitales<br>atomiques]] |
||
| colspan |
| colspan="2" | [[Fichier:Electron orbitals crop.svg|250px]] |
||
|- |
|- |
||
| |
| |
||
| style="font-size:87%" width="144px" | {{nobr|Liaisons {{math|σ}}}} entre<br>[[Orbitale atomique|{{nobr|orbitales atomiques}}]]<br>s–s et p–p |
| style="vertical-align:top; font-size:87%" width="144px" | {{nobr|Liaisons {{math|σ}}}} entre<br>[[Orbitale atomique|{{nobr|orbitales atomiques}}]]<br>s–s et p–p |
||
| style="font-size:87%" | [[Liaison π|{{nobr|Liaison {{math|π}}}}]]<br> |
| style="vertical-align:top; font-size:87%" | [[Liaison π|{{nobr|Liaison {{math|π}}}}]]<br>pour comparaison |
||
|- style="font-size:6px; color:silver" |
|- style="font-size:6px; color:silver" |
||
|——||————————————————||————— |
|——||————————————————||————— |
||
|- |
|- |
||
| colspan |
| colspan="2" style="vertical-align:bottom; font-size:87%" | [[Fichier:Molecular orbital of hydrogen fluoride.svg|144px]]<br>[[Fluorure d'hydrogène]] HF |
||
| [[Fichier:Molecular orbital of |
| style="vertical-align:bottom; font-size:87%" | [[Fichier:Molecular orbital of acetylene.svg|128px]]<br>[[Acétylène]] {{nobr|HC≡CH}} |
||
|} |
|} |
||
Une '''liaison {{math|σ}}''' ( |
Une '''liaison {{math|σ}}''' (prononcé ''[[sigma]]'') est une [[liaison chimique]] [[Liaison covalente|covalente]] formée par le [[Recouvrement d'orbitales|recouvrement]] axial de deux [[Orbitale atomique|orbitales atomiques]]<ref name="978-0495390794">{{en}} John Moore, Conrad L. Stanitski et Peter C. Jurs, ''Principles of Chemistry: The Molecular Science'', 2009. {{ISBN|978-0495390794}}</ref>. Dans une [[molécule diatomique]] [[Molécule homonucléaire|homonucléaire]], la [[densité électronique]] est maximum le long de l'axe internucléaire, lequel n'est intersecté par aucun [[plan nodal]]. De telles liaisons peuvent résulter du recouvrement d'orbitales {{nobr|s + s}}, {{nobr|p{{ind|z}} + p{{ind|z}}}}, {{nobr|s + p{{ind|z}}}} ou {{nobr|d{{ind|z{{exp|2}}}} + d{{ind|z{{exp|2}}}}}}, où z est l'axe internucléaire<ref name="978-0199270293">{{en}} Jonathan Clayden, Nick Greeves et Stuart Warren, ''Organic Chemistry'', {{2e|{{éd.}}}}, OUP Oxford, 2012, {{p.|101-136}}. {{ISBN|978-0199270293}}</ref>. Dans ces molécules, le concept de {{nobr|liaison {{math|σ}}}} est équivalent à celui d'[[orbitale moléculaire]] {{math|σ}}. Dans cette dernière, la densité électronique est distribuée selon une [[symétrie circulaire]] autour de l'axe interatomique. Plus généralement, les {{nobr|liaisons {{math|σ}}}} se forment par recouvrement axial d'orbitales atomiques, ce qui fait qu'une molécule d'[[alcane]] comme le [[propane]] {{fchim|C|3|H|8}} est unie par dix {{nobr|liaisons {{math|σ}}}}, à savoir huit liaisons {{nobr|[[Carbone|C]]–[[Hydrogène|H]]}} et deux liaisons {{nobr|[[Carbone|C]]–[[Carbone|C]]}}. |
||
<gallery mode="packed" heights="120px"> |
<gallery mode="packed" heights="120px"> |
||
| Ligne 36 : | Ligne 36 : | ||
}}.</ref>, illustrant qu'une {{nobr|liaison {{math|σ}}}} est plus forte que des {{nobr|liaisons {{math|π}}}}. |
}}.</ref>, illustrant qu'une {{nobr|liaison {{math|σ}}}} est plus forte que des {{nobr|liaisons {{math|π}}}}. |
||
Les [[Complexe (chimie)|complexes]] de [[Métal de transition|métaux de transition]] qui présentent des [[Liaison multiple|liaisons multiples]], comme les |
Les [[Complexe (chimie)|complexes]] de [[Métal de transition|métaux de transition]] qui présentent des [[Liaison multiple|liaisons multiples]], comme les [[Complexe de dihydrogène|complexes de dihydrogène]], ont des {{nobr|liaisons {{math|σ}}}} entre les atomes unis par des liaisons multiples. Ces {{nobr|liaisons {{math|σ}}}} peuvent être complétées par d'autres interactions telles que des [[Rétrocoordination π|{{nobr|rétrocoordinations {{math|π}}}}]], comme dans le cas de {{fchim|W(CO)|3}}({{Lien|langue=en|trad=Tricyclohexylphosphine|fr=Tricyclohexylphosphine|texte={{fchim|PCy|3}}}}{{fchim|)|2|(H|2}}) ou encore des [[Liaison δ|{{nobr|liaisons {{math|δ}}}}]], comme dans le cas de l'[[acétate de chrome(II)]] {{fchim|Cr|2|(CH|3|CO|2|)|4|(H|2|O)|2}}<ref name="10.1021/ja0153417"> |
||
{{Article |
{{Article |
||
| langue = en |
| langue = en |
||
| Ligne 54 : | Ligne 54 : | ||
| bibcode = |
| bibcode = |
||
}}</ref>. |
}}</ref>. |
||
== Molécules organiques == |
|||
Les [[molécule]]s [[Composé organique|organiques]] présentent souvent des combinaisons de {{nobr|liaisons {{math|σ}}}} et de [[Liaison π|{{nobr|liaisons {{math|π}}}}]] dans des [[Composé chimique|composés]] qui peuvent être [[Composé cyclique|cycliques]] ou [[Composé à chaîne ouverte|à chaîne ouverte]]. Le nombre ''N''{{ind|{{math|σ}}}} de {{nobr|liaisons {{math|σ}}}} de telles molécules peut être déduit par analogie avec la [[caractéristique d'Euler]] en considérant que les [[atome]]s sont des [[Sommet (géométrie)|sommets]], les {{nobr|[[Liaison chimique|liaisons]] {{math|σ}}}} des [[Arête (géométrie)|arêtes]], et les [[Composé cyclique|cycles]] des [[Face (géométrie)|faces]] : |
|||
:''N''{{ind|{{math|σ}}}} = ''N''{{ind|[[atome]]s}} + ''N''{{ind|[[Composé cyclique|cycles]]}} – 1. |
|||
Cette formule fonctionne bien pour les molécules qui peuvent être représentées de manière bidimensionnelle : le [[méthane]] {{fchim|CH|4}} contient ainsi quatre {{nobr|liaisons {{math|σ}}}}, l'[[éthane]] {{fchim|C|2|H|6}} en contient sept (six liaisons {{nobr|[[Carbone|C]]–[[Hydrogène|H]]}} et une liaison {{nobr|[[Carbone|C]]–[[Carbone|C]]}}), l'{{page h'|hexane}} {{fchim|C|6|H|14}} en contient 19, le [[cyclohexane]] {{fchim|C|6|H|12}} en contient 18, le [[benzène]] {{fchim|C|6|H|6}} en contient 12, le [[naphtalène]] {{fchim|C|10|H|8}} en contient 19{{etc.}} Dans certains cas, il peut s'agir d'une {{nobr|liaison {{math|σ}}}} virtuelle, comme pour le [[carbone diatomique]] {{fchim|C|2}} uni seulement par deux {{nobr|liaisons {{math|π}}}} mais qui contient également une {{nobr|liaison {{math|σ}}}} annulée par une [[Orbitale antiliante|{{nobr|orbitale {{math|σ*}}}} antiliante]]. |
|||
Cette formule atteint ses limites avec des composés plus complexes dont la géométrie ne peut être représentée simplement dans un plan, ce qui modifie la caractéristique d'Euler. C'est par exemple le cas du [[buckminsterfullerène]] {{fchim|C|60}}, qui contient {{unité|60|atomes}}, {{unité|32|cycles}} et {{unité|90|{{nobr|liaisons {{math|σ}}}}}} ; la formule donnerait, quant à elle, {{nobr|60 + 32 – 1 {{=}} 91 liaisons {{math|σ}}}}. |
|||
== Notes et références == |
== Notes et références == |
||
Dernière version du 7 décembre 2023 à 14:54
| —— | ———————————————— | ————— |
Orbitales atomiques |

| |
| Liaisons σ entre orbitales atomiques s–s et p–p |
Liaison π pour comparaison | |
| —— | ———————————————— | ————— |
 Fluorure d'hydrogène HF |
 Acétylène HC≡CH | |
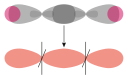
Une liaison σ (prononcé sigma) est une liaison chimique covalente formée par le recouvrement axial de deux orbitales atomiques[1]. Dans une molécule diatomique homonucléaire, la densité électronique est maximum le long de l'axe internucléaire, lequel n'est intersecté par aucun plan nodal. De telles liaisons peuvent résulter du recouvrement d'orbitales s + s, pz + pz, s + pz ou dz2 + dz2, où z est l'axe internucléaire[2]. Dans ces molécules, le concept de liaison σ est équivalent à celui d'orbitale moléculaire σ. Dans cette dernière, la densité électronique est distribuée selon une symétrie circulaire autour de l'axe interatomique. Plus généralement, les liaisons σ se forment par recouvrement axial d'orbitales atomiques, ce qui fait qu'une molécule d'alcane comme le propane C3H8 est unie par dix liaisons σ, à savoir huit liaisons C–H et deux liaisons C–C.
-
Liaison σ entre deux atomes : localisation de la densité électronique.
Propriétés[modifier | modifier le code]
Les liaisons σ sont les liaisons covalentes les plus fortes car le recouvrement axial est plus important que le recouvrement latéral d'une liaison π ou d'une liaison δ. Il ne peut exister qu'une seule liaison σ entre deux atomes. Une liaison simple est généralement une liaison σ, tandis qu'une double liaison est généralement formée d'une liaison σ et d'une liaison π et qu'une triple liaison est typiquement constituée d'une liaison σ et de deux liaisons π. L'énergie de dissociation de la liaison C–C de l'éthane H3C–CH3 vaut 347 à 377 kJ/mol, tandis que celle de l'éthylène H2C=CH2 vaut 710 kJ/mol et celle de l'acétylène HC≡CH vaut 960 kJ/mol[3], illustrant qu'une liaison σ est plus forte que des liaisons π.
Les complexes de métaux de transition qui présentent des liaisons multiples, comme les complexes de dihydrogène, ont des liaisons σ entre les atomes unis par des liaisons multiples. Ces liaisons σ peuvent être complétées par d'autres interactions telles que des rétrocoordinations π, comme dans le cas de W(CO)3(PCy3 (en))2(H2) ou encore des liaisons δ, comme dans le cas de l'acétate de chrome(II) Cr2(CH3CO2)4(H2O)2[4].
Molécules organiques[modifier | modifier le code]
Les molécules organiques présentent souvent des combinaisons de liaisons σ et de liaisons π dans des composés qui peuvent être cycliques ou à chaîne ouverte. Le nombre Nσ de liaisons σ de telles molécules peut être déduit par analogie avec la caractéristique d'Euler en considérant que les atomes sont des sommets, les liaisons σ des arêtes, et les cycles des faces :
Cette formule fonctionne bien pour les molécules qui peuvent être représentées de manière bidimensionnelle : le méthane CH4 contient ainsi quatre liaisons σ, l'éthane C2H6 en contient sept (six liaisons C–H et une liaison C–C), l'hexane C6H14 en contient 19, le cyclohexane C6H12 en contient 18, le benzène C6H6 en contient 12, le naphtalène C10H8 en contient 19, etc. Dans certains cas, il peut s'agir d'une liaison σ virtuelle, comme pour le carbone diatomique C2 uni seulement par deux liaisons π mais qui contient également une liaison σ annulée par une orbitale σ* antiliante.
Cette formule atteint ses limites avec des composés plus complexes dont la géométrie ne peut être représentée simplement dans un plan, ce qui modifie la caractéristique d'Euler. C'est par exemple le cas du buckminsterfullerène C60, qui contient 60 atomes, 32 cycles et 90 liaisons σ ; la formule donnerait, quant à elle, 60 + 32 – 1 = 91 liaisons σ.
Notes et références[modifier | modifier le code]
- (en) John Moore, Conrad L. Stanitski et Peter C. Jurs, Principles of Chemistry: The Molecular Science, 2009. (ISBN 978-0495390794)
- (en) Jonathan Clayden, Nick Greeves et Stuart Warren, Organic Chemistry, 2e éd., OUP Oxford, 2012, p. 101-136. (ISBN 978-0199270293)
-
(en) R. G. Bergman et A. Streitwieser, « Bond Dissociation Energies (DH0
298, kcal mol-1) for A-B Bonds » [PDF], Université de Californie à Berkeley, (consulté le ). - (en) Ray L. Sweany, « Metal Dihydrogen and σ-Bond Complexes: Structure, Theory, and Reactivity By Gregory J. Kubas, Los Alamos National Laboratory, Kluwer Academic/Plenum Publishers: New York. 2001 », Journal of the American Chemical Society, vol. 124, no 14, , p. 3799-3800 (DOI 10.1021/ja0153417, lire en ligne)

