« Isotope » : différence entre les versions
Aucun résumé des modifications |
m Typographie |
||
| (48 versions intermédiaires par 34 utilisateurs non affichées) | |||
| Ligne 2 : | Ligne 2 : | ||
[[Fichier:Isotope CNO.svg|thumb|upright=1.2|Quelques isotopes de l'[[oxygène]], de l'[[azote]] et du [[carbone]].]] |
[[Fichier:Isotope CNO.svg|thumb|upright=1.2|Quelques isotopes de l'[[oxygène]], de l'[[azote]] et du [[carbone]].]] |
||
Deux [[nucléide]]s d'un même [[élément chimique]] sont dits '''isotopes''' s'ils partagent le même nombre de [[proton]]s, ''Z'', mais ont des nombres différents de [[neutron]]s, ''N''<ref>{{lien web |titre=isotopes |url=https://goldbook.iupac.org/terms/view/I03331 |auteur=[[IUPAC]] |consulté le=9 octobre 2023}}</ref>. |
|||
* On appelle '''isotopes''' (d'un certain [[élément chimique]]) les [[nucléide]]s partageant le même nombre de protons (caractéristique de cet élément), mais ayant un nombre de neutrons différent. Autrement dit, si l'on considère deux nucléides dont les nombres de protons sont ''Z'' et ''Z{{'}}'', et les nombres de neutrons ''N'' et ''N{{'}}'', ces nucléides sont dits isotopes si ''Z = Z{{'}}'' et ''N ≠ N{{'}}''. |
|||
Par extension, un '''isotope''' est une classe d'atomes caractérisée par son nombre de protons ''Z'' et son nombre de neutrons ''N''<ref>{{Larousse|mot=Isotope|numéro=44535|consulté le=9 octobre 2023}}</ref>, sans distinction concernant le [[spin]] ou l'[[isomérie nucléaire|état énergétique]]. |
|||
{{théorème |
{{théorème |
||
| Ligne 16 : | Ligne 17 : | ||
== Notation == |
== Notation == |
||
Chaque isotope est représenté par un symbole |
Chaque isotope est représenté par un symbole {{Nucléide|{{mvar|A}}|{{mvar|Z}}|{{serif|M}}}} composé de : |
||
* son symbole chimique M ([[Liste des éléments chimiques|H, He, Li, etc.]]) ; |
* son symbole chimique {{serif|M}} ([[Liste des éléments chimiques|H, He, Li, etc.]]) ; |
||
* son [[nombre de masse]] |
* son [[nombre de masse]] {{mvar|A}} (égal au nombre de [[nucléon]]s de l'atome), placé en haut et à gauche du symbole chimique ; |
||
* son [[numéro atomique]] |
* son [[numéro atomique]] {{mvar|Z}} (égal au nombre de [[proton]]s), placé en bas et à gauche du symbole chimique. |
||
Le carbone 12 et le [[carbone 14]], deux isotopes de l'élément [[carbone]], sont ainsi notés {{ |
Le [[carbone 12]] et le [[carbone 14]], deux isotopes de l'élément [[carbone]], sont ainsi notés {{Nucléide|12|6|C|Carbone 12}} et {{Nucléide|14|6|C|Carbone 14}}. Le numéro atomique est souvent omis, car redondant avec le symbole chimique<ref group=alpha>On indique le numéro atomique quand il aide à la compréhension, et notamment dans les [[réaction nucléaire|réactions nucléaires]] et les [[désintégration radioactive|réactions de désintégration]] pour comprendre le sort de chaque type de particule ([[proton]] ou [[neutron]]).</ref> : {{12}}C et {{14}}C, par exemple. |
||
On peut également représenter les isotopes par leur nom suivi de leur nombre de masse séparé par une espace (et non un tiret, contrairement à l'anglais) : {{nobr|[[carbone 14]]}}, {{nobr|[[oxygène 18]]}}, {{nobr|[[fer 56]]}}{{etc.}} |
On peut également représenter les isotopes par leur nom suivi de leur nombre de masse séparé par une espace (et non un tiret, contrairement à l'anglais) : {{nobr|[[carbone 14]]}}, {{nobr|[[oxygène 18]]}}, {{nobr|[[fer 56]]}}{{etc.}} |
||
| Ligne 29 : | Ligne 30 : | ||
== Propriétés == |
== Propriétés == |
||
Les propriétés des atomes étant essentiellement régies par leurs [[Configuration électronique|cortèges électroniques]], les isotopes d'un même élément chimique ont essentiellement les mêmes propriétés physiques et chimiques, qualitativement et quantitativement<ref group=alpha>Compte tenu du rapport des masses, pour ce qui concerne les [[grandeur spécifique|grandeurs par unité de masse]].</ref>. La différence de masse entre isotopes, parce qu'elle affecte l'[[énergie cinétique]] des atomes et des [[molécule]]s, entraîne cependant de légères différences de propriétés, appelées [[Effet isotopique|effets isotopiques]]. Ces effets sont d'autant plus importants que la différence relative de masse est grande ; ils sont donc maximaux pour l'[[hydrogène]] (la masse de [[deutérium|{{exp|2}}H]] est le double de celle de [[protium|{{exp|1}}H)]] et minimaux pour les éléments les plus lourds (la masse de [[uranium 235|{{exp|235}}U]], par exemple, n'est supérieure à celle de [[uranium 234|{{exp|234}}U]] que de 0,4 %). |
Les propriétés des atomes étant essentiellement régies par leurs [[Configuration électronique|cortèges électroniques]], les isotopes d'un même élément chimique ont essentiellement les mêmes propriétés physiques et chimiques, qualitativement et quantitativement<ref group=alpha>Compte tenu du rapport des masses, pour ce qui concerne les [[grandeur spécifique|grandeurs par unité de masse]].</ref>. La différence de masse entre isotopes, parce qu'elle affecte l'[[énergie cinétique]] des atomes et des [[molécule]]s, entraîne cependant de légères différences de propriétés, appelées [[Effet isotopique|effets isotopiques]]. Ces effets sont d'autant plus importants que la différence relative de masse est grande ; ils sont donc maximaux pour l'[[hydrogène]] (la masse de [[deutérium|{{exp|2}}H]] est le double de celle de [[protium|{{exp|1}}H)]] et minimaux pour les éléments les plus lourds (la masse de [[uranium 235|{{exp|235}}U]], par exemple, n'est supérieure à celle de [[uranium 234|{{exp|234}}U]] que de 0,4 %). |
||
* Un premier effet concerne les propriétés à l'équilibre. Quand dans un [[corps simple]] on remplace un atome par un isotope plus lourd, on augmente notamment, mais légèrement, les températures [[point de fusion|de fusion]] et [[point d'ébullition|d'ébullition]], ainsi que les chaleurs latentes correspondantes ([[enthalpie de fusion|de fusion]] et [[enthalpie de vaporisation|de vaporisation]]). Leurs valeurs sont ainsi de {{tmp|3.81|°C}}, {{tmp|101.42|°C}}, {{unité|6.132|kJ/mol}} et {{unité|41.521|kJ/mol}} pour l'[[eau lourde]] {{fchim|{{exp|2}}H|2|{{exp|16}}O}}, contre {{tmp|0|°C}}, {{tmp|100|°C}}, {{unité|6.007|kJ/mol}} et {{unité|40.657|kJ/mol}} pour l'[[eau légère]] {{fchim|{{exp|1}}H|2|{{exp|16}}O}}. |
* Un premier effet concerne les propriétés à l'équilibre. Quand dans un [[corps simple]] on remplace un [[atome]] par un isotope plus lourd, on augmente notamment, mais légèrement, les températures [[point de fusion|de fusion]] et [[point d'ébullition|d'ébullition]], ainsi que les chaleurs latentes correspondantes ([[enthalpie de fusion|de fusion]] et [[enthalpie de vaporisation|de vaporisation]]). Leurs valeurs sont ainsi de {{tmp|3.81|°C}}, {{tmp|101.42|°C}}, {{unité|6.132|kJ/mol}} et {{unité|41.521|kJ/mol}} pour l'[[eau lourde]] {{fchim|{{exp|2}}H|2|{{exp|16}}O}}, contre {{tmp|0|°C}}, {{tmp|100|°C}}, {{unité|6.007|kJ/mol}} et {{unité|40.657|kJ/mol}} pour l'[[eau légère]] {{fchim|{{exp|1}}H|2|{{exp|16}}O}}. |
||
* Un second effet concerne la vitesse des processus de retour à l'équilibre (écoulement, [[diffusion de la matière|diffusion]], [[cinétique chimique|réactions chimiques]], etc.). Quand dans un [[corps simple]] on remplace un atome par un isotope plus lourd, toutes ces vitesses sont diminuées. La [[viscosité dynamique|viscosité]] de l'eau à {{tmp|20|°C}} est ainsi de {{unité|1.2467|e=-3|Pa||s}} pour l'eau lourde, contre {{unité|1.0016|e=-3|Pa||s}} pour l'eau légère. |
* Un second effet concerne la vitesse des processus de retour à l'équilibre (écoulement, [[diffusion de la matière|diffusion]], [[cinétique chimique|réactions chimiques]], etc.). Quand dans un [[corps simple]] on remplace un atome par un isotope plus lourd, toutes ces vitesses sont diminuées. La [[viscosité dynamique|viscosité]] de l'eau à {{tmp|20|°C}} est ainsi de {{unité|1.2467|e=-3|Pa||s}} pour l'eau lourde, contre {{unité|1.0016|e=-3|Pa||s}} pour l'eau légère. |
||
| Ligne 35 : | Ligne 36 : | ||
== Stabilité == |
== Stabilité == |
||
Il existe 80 [[éléments chimiques]] ayant au moins un [[isotope stable]], de l'[[hydrogène]] {{ind|1}}H au [[plomb]] {{ind|82}}Pb (81 éléments si l'on inclut le [[bismuth]] {{ind|83}}Bi<ref group=alpha>On sait depuis 2003 que le [[bismuth 209]] est radioactif, mais sa [[période radioactive|demi-vie]] est tellement grande ({{unité|19|e=18|années}} donc plus d'un milliard de fois l'[[âge de l'univers]] !) que pour toute considération pratique on peut le considérer comme stable.</ref>). Le [[technétium]] {{ind|43}}Tc, le [[prométhium]] {{ind|61}}Pm et tous les éléments de [[numéro atomique]] supérieur à 83 n'ont, quant à eux, aucun isotope stable. |
Il existe 80 [[Élément chimique|éléments chimiques]] ayant au moins un [[isotope stable]], de l'[[hydrogène]] {{ind|1}}H au [[plomb]] {{ind|82}}Pb (81 éléments si l'on inclut le [[bismuth]] {{ind|83}}Bi<ref group=alpha>On sait depuis 2003 que le [[bismuth 209]] est radioactif, mais sa [[période radioactive|demi-vie]] est tellement grande ({{unité|19|e=18|années}} donc plus d'un milliard de fois l'[[âge de l'univers]] !) que pour toute considération pratique on peut le considérer comme stable.</ref>). Le [[technétium]] {{ind|43}}Tc, le [[prométhium]] {{ind|61}}Pm et tous les éléments de [[numéro atomique]] supérieur à 83 n'ont, quant à eux, aucun isotope stable. |
||
[[Fichier:Table isotopes.svg|vignette|[[Carte des nucléides|Diagramme ''Z-N'']] et [[vallée de stabilité]] des isotopes. |
[[Fichier:Table isotopes.svg|vignette|[[Carte des nucléides|Diagramme ''Z-N'']] et [[vallée de stabilité]] des isotopes. |
||
| Ligne 45 : | Ligne 46 : | ||
Pour ces centaines d'isotopes naturels, les nombres respectifs de protons et de neutrons semblent respecter certaines règles : |
Pour ces centaines d'isotopes naturels, les nombres respectifs de protons et de neutrons semblent respecter certaines règles : |
||
* le nombre de neutrons est à peu près égal à celui des protons pour les éléments légers ; à partir du <sub>21</sub>Sc, le nombre de neutrons devient supérieur au nombre de protons, l'excédent dépassant 50 % pour les éléments les plus lourds ; |
* le nombre de neutrons est à peu près égal à celui des protons pour les éléments légers ; à partir du <sub>21</sub>Sc, le nombre de neutrons devient supérieur au nombre de protons, l'excédent dépassant 50 % pour les éléments les plus lourds ; |
||
* certains noyaux particulièrement stables contiennent des protons ou des neutrons (ou les deux) en nombre égal à un des « [[Nombre magique (physique)|nombres magiques]] » suivants : {{retrait|1= 2, 8, 20, 28, 50, 82, 126. }} |
* certains noyaux particulièrement stables contiennent des protons ou des neutrons (ou les deux) en nombre égal à un des « [[Nombre magique (physique)|nombres magiques]] » suivants : {{retrait|1= 2, 8, 20, 28, 50, 82, 126. }}Selon les théories actuelles, ces valeurs correspondraient à des noyaux possédant des couches complètes de neutrons ou de protons ; |
||
<!-- Incompréhensible... |
<!-- Incompréhensible... |
||
| Ligne 64 : | Ligne 65 : | ||
Le noyau à 126 protons n'a pas pu être créé encore ; il sera instable sans doute mais on approche de cette valeur en combinant 2 atomes. --> |
Le noyau à 126 protons n'a pas pu être créé encore ; il sera instable sans doute mais on approche de cette valeur en combinant 2 atomes. --> |
||
* les éléments de nombre Z impair possèdent moins d'isotopes stables que les éléments de nombre Z pair. |
* les éléments de nombre Z impair possèdent moins d'isotopes stables que les éléments de nombre Z pair. |
||
Il existe des milliers de noyaux instables, de durée de vie très courte (jusqu'à {{unité|e-23 seconde}}), qui ne peuvent être produits qu'en laboratoire. On les qualifie de [[Noyau exotique|noyaux exotiques]], notamment en raison de leurs propriétés spécifiques (grandes déformations, halos de neutron, etc.). |
|||
== Utilisations == |
== Utilisations == |
||
=== Analyse isotopique === |
=== Analyse isotopique === |
||
Un exemple très connu de couple d'isotopes est constitué par le [[carbone]] : le carbone est présent en grande majorité sous son isotope de |
Un exemple très connu de couple d'isotopes est constitué par le [[carbone]] : le carbone est présent en grande majorité sous son isotope de [[masse atomique]] 12 (le « {{nobr|carbone 12}} ») ; d'autre part, on peut trouver en faible quantité l'isotope de masse atomique 14 (le {{nobr|[[carbone 14]]}}), qui est chimiquement strictement équivalent au {{nobr|carbone 12}}, mais qui est radioactif. En effet, les neutrons supplémentaires du noyau rendent l'atome instable. Il se désintègre en donnant de {{nobr|l'[[azote]] 14}} et en émettant un [[radioactivité|rayonnement bêta]]. |
||
* Le rapport {{exp|18}}O/{{exp|16}}O (par exemple dans les apatites des fossiles de vertébrés) permet, dans une certaine mesure, de reconstituer certains paléoclimats<ref>Živilė Žigaité, ''Le rapport {{exp|18}}O/{{exp|16}}O dans les apatites des vertébrés du Paléozoïque : possibilités et limites des reconstitutions paléoclimatiques'' ; Palaeoclimate and Stable Isotope Geochemistry</ref> ; |
* Le rapport {{exp|18}}O/{{exp|16}}O (par exemple dans les apatites des fossiles de [[vertébrés]]) permet, dans une certaine mesure, de reconstituer certains paléoclimats<ref>Živilė Žigaité, ''Le rapport {{exp|18}}O/{{exp|16}}O dans les apatites des vertébrés du Paléozoïque : possibilités et limites des reconstitutions paléoclimatiques'' ; Palaeoclimate and Stable Isotope Geochemistry</ref> ; |
||
* Dans le domaine médical ([[médecine légale]], [[médecine du travail]], [[toxicologie]]{{etc.}}) l'analyse isotopique permet de différencier diverses sources de contamination, et souvent d'identifier ainsi la source d'une intoxication<ref>{{article| auteur1=S. C. Maisant| auteur2=A. F. Villa| auteur3=J. Poupon| auteur4=J. Langrand| auteur5=R. Garnier| année=2016| titre=L’analyse isotopique du plomb: un outil utile en santé au travail quand les sources d’exposition au plomb sont multiples| périodique=Archives des Maladies Professionnelles et de l'Environnement| volume=77| numéro=3|pages=485| résumé=http://www.sciencedirect.com/science/article/pii/S1775878516306622}}.</ref> |
* Dans le domaine médical ([[médecine légale]], [[médecine du travail]], [[toxicologie]]{{etc.}}) l'analyse isotopique permet de différencier diverses sources de contamination, et souvent d'identifier ainsi la source d'une intoxication<ref>{{article| auteur1=S. C. Maisant| auteur2=A. F. Villa| auteur3=J. Poupon| auteur4=J. Langrand| auteur5=R. Garnier| année=2016| titre=L’analyse isotopique du plomb: un outil utile en santé au travail quand les sources d’exposition au plomb sont multiples| périodique=Archives des Maladies Professionnelles et de l'Environnement| volume=77| numéro=3|pages=485| résumé=http://www.sciencedirect.com/science/article/pii/S1775878516306622}}.</ref>. |
||
* Dans le domaine de l'[[évaluation environnementale]], l'analyse isotopique d'un organisme, du [[Sol (pédologie)|sol]] ou de [[sédiment]]s permet de |
* Dans le domaine de l'[[évaluation environnementale]], l'analyse isotopique d'un organisme, du [[Sol (pédologie)|sol]] ou de [[sédiment]]s permet de différencier la partie naturelle de la part anthropique d'une contamination par certains métaux, dont le plomb<ref name=AnIsotop2012>{{article| langue=en| auteur1=P. Álvarez-Iglesias| auteur2=B. Rubio| auteur3=J. Millos| titre=Isotopic identification of natural vs. anthropogenic lead sources in marine sediments from the inner Ría de Vigo (NW Spain)| périodique=Science of The Total Environment| volume=437| jour=15| mois=octobre| année=2012| pages=22-35}}.</ref>. Sur la base de signatures isotopiques particulières, on peut distinguer le plomb de céramiques, du plomb issu de la combustion du charbon et de l'essence<ref name=AnIsotop2012/>. On peut ainsi tracer l'origine d'une pollution actuelle ou passée (déposée dans les sédiments). On a ainsi pu montrer que dans la Baie de San Simón (partie intérieure de la [[Rías Baixas|Ría de Vigo]] située au nord-ouest de l'Espagne), selon les époques, l'homme a été responsable de 25 à 98 % des apports de plomb trouvé dans les échantillons de la [[estran|zone intertidale]], et de 9 à 84 % dans les échantillons [[zone néritique|subtidaux]]. Les variations temporelles observées dans les carottes de sédiments ont pu être reliées, d'abord aux retombées de [[fumée]]s de combustion de [[charbon]] (60 à 70 % du plomb de la baie) avant la création d'une usine de [[céramique]] dans la région (dans les années 1970), qui est alors devenue la principale source de plomb (de 95 à 100 % des apports), avant qu'une nouvelle source soit dominante : l'[[tétraéthylplomb|essence plombée]]<ref name=AnIsotop2012/>. L'histoire des immiscions de plomb dans l'environnement de cette baie a pu être ainsi déterminée pour tout le {{s-|XX|e}}, et même pour le {{s-|XIX|e}} pour la zone subtidale<ref name=AnIsotop2012/>. |
||
* L'analyse isotopique est utilisée dans les études du [[réseau trophique]]. En effet, les consommateurs présentent une signature isotopique directement reliée à celle de leurs aliments (elle en diffère peu, et suivant une loi connue). En analysant les rapports isotopiques d'un consommateur et de ses aliments potentiels, il est possible de reconstituer le régime probable du consommateur<ref name=HetteTronquart2016>N Hette-Tronquart, J Belliard, ''Caractérisation des réseaux trophiques en cours d’eau'', 2016 ([https://www.researchgate.net/publication/299511665_STUDY_OF_STREAM_FOOD_WEBS_-_RESULTS_AND_SYNTHESIS_OF_PROJECT_33_1ST_STAGE_2013-2015_PERSPECTIVES_FOR_THE_NEXT_STAGE_2016-2017])</ref>. |
* L'analyse isotopique est utilisée dans les études du [[réseau trophique]]. En effet, les consommateurs présentent une signature isotopique directement reliée à celle de leurs aliments (elle en diffère peu, et suivant une loi connue). En analysant les rapports isotopiques d'un consommateur et de ses aliments potentiels, il est possible de reconstituer le régime probable du consommateur<ref name="HetteTronquart2016">N Hette-Tronquart, J Belliard, ''Caractérisation des réseaux trophiques en cours d’eau'', 2016 ([https://www.researchgate.net/publication/299511665_STUDY_OF_STREAM_FOOD_WEBS_-_RESULTS_AND_SYNTHESIS_OF_PROJECT_33_1ST_STAGE_2013-2015_PERSPECTIVES_FOR_THE_NEXT_STAGE_2016-2017])</ref>. |
||
* La lutte contre les [[fraude]]s utilise la précision de ces analyses pour élucider des responsabilités criminelles (détermination de la marque d'une cartouche de chasse ou origine d'une balle à partir d'un échantillon de plomb) ou de fraudes alimentaires<ref name=Piasentier2003/> (par exemple l'analyse des [[rapport isotopique|rapports isotopiques]] stables ({{exp|13}}C/{{exp|12}}C et {{exp|15}}N/{{exp|14}}N) d'échantillons de viande d'agneau (mesurée par spectrométrie de masse isotopique) permet de confirmer ou infirmer une origine géographique, ou même de savoir si l'animal a uniquement tété le lait de sa mère, ou reçu des supplémentations solides (maïs, soja…) ou été nourri d'herbe naturelle<ref name=Piasentier2003/>… <br/> Ces analyses permettent aussi de différencier certains types d'agneau, mais aussi de vin, de jus de fruits, de miel<ref name=Piasentier2003>E. Piasentier, R. Valusso, F. Camin, G. Versini, ''Stable isotope ratio analysis for authentication of lamb meat'' ; Meat Science, Volume 64, Issue 3, July 2003, Pages 239–247 ([Résumé])</ref> ou de produits laitiers et fromages (dont AOC par exemple<ref>M.A Brescia, M Monfreda, A Buccolieri, C Carrino, ''Characterisation of the geographical origin of buffalo milk and mozzarella cheese by means of analytical and spectroscopic determinations'' ; Food Chemistry Volume 89, Issue 1, January 2005, Pages 139–147 ([http://www.sciencedirect.com/science/article/pii/S0308814604001827 résumé])</ref>). <br/> |
* La lutte contre les [[fraude]]s utilise la précision de ces analyses pour élucider des responsabilités criminelles (détermination de la marque d'une cartouche de chasse ou origine d'une balle à partir d'un échantillon de plomb) ou de [[Fraude alimentaire|fraudes alimentaires]]<ref name=Piasentier2003/> (par exemple l'analyse des [[rapport isotopique|rapports isotopiques]] stables ({{exp|13}}C/{{exp|12}}C et {{exp|15}}N/{{exp|14}}N) d'échantillons de viande d'agneau (mesurée par spectrométrie de masse isotopique) permet de confirmer ou infirmer une origine géographique, ou même de savoir si l'animal a uniquement tété le lait de sa mère, ou reçu des supplémentations solides (maïs, soja…) ou été nourri d'herbe naturelle<ref name=Piasentier2003/>… <br/> Ces analyses permettent aussi de différencier certains types d'agneau, mais aussi de vin, de jus de fruits, de miel<ref name=Piasentier2003>E. Piasentier, R. Valusso, F. Camin, G. Versini, ''Stable isotope ratio analysis for authentication of lamb meat'' ; Meat Science, Volume 64, Issue 3, July 2003, Pages 239–247 ([Résumé])</ref> ou de produits laitiers et fromages (dont AOC par exemple<ref>M.A Brescia, M Monfreda, A Buccolieri, C Carrino, ''Characterisation of the geographical origin of buffalo milk and mozzarella cheese by means of analytical and spectroscopic determinations'' ; Food Chemistry Volume 89, Issue 1, January 2005, Pages 139–147 ([http://www.sciencedirect.com/science/article/pii/S0308814604001827 résumé])</ref>). <br/>Un simple échantillon haché solide suffit et permet d'acquérir l'information pour un grand nombre de métabolites (acides aminés, acides gras, sucres, etc.)<ref>D. Sacco, M.A. Brescia, A. Buccolieri, A. Caputi Jambrenghi, ''Geographical origin and breed discrimination of Apulian lamb meat samples by means of analytical and spectroscopic determinations'' ; Meat Science Volume 71, Issue 3, November 2005, Pages 542–548 ([http://www.sciencedirect.com/science/article/pii/S0309174005001865 Résumé])</ref>. |
||
==== L'analyse isotopique en archéologie ==== |
|||
Depuis les années 90, l’[[archéologie]] a connu de nombreuses avancées en termes de techniques d’analyse, ce qui a non seulement permis de dater des échantillons, mais aussi d’obtenir des informations sur l’alimentation des populations animales et humaines<ref name=":0">{{Article|langue=fr|prénom1=Estelle|nom1=Herrscher|titre=Détection isotopique des modalités d’allaitement et de sevrage à partir des ossements archéologiques|périodique=Cahiers de Nutrition et de Diététique|volume=48|numéro=2|pages=75–85|date=2013-04|doi=10.1016/j.cnd.2012.12.004|lire en ligne=https://linkinghub.elsevier.com/retrieve/pii/S0007996012002258|consulté le=2023-12-10}}</ref>. Il est donc possible de savoir quel régime alimentaire a été suivi par un individu à une époque et à une localisation donnée et ce à différents moments de sa vie selon le tissu squelettique étudié<ref name=":1">{{Article|prénom1=Estelle|nom1=Herrscher|titre=Alimentation d’une population historique: Analyse des données isotopiques de la nécropole Saint-Laurent de Grenoble ({{sp-|XIII|-|X}}, France)|périodique=Bulletins et mémoires de la société d'anthropologie de Paris|volume=15|numéro=3-4|pages=149–269|date=2003-12-01|issn=0037-8984|issn2=1777-5469|doi=10.4000/bmsap.550|lire en ligne=http://journals.openedition.org/bmsap/550|consulté le=2023-12-10}}</ref>. En effet, la composition chimique des ossements dépend en partie des aliments consommés durant la vie et plus généralement de l’environnement de vie<ref name=":0" />. Avec ces informations, il est possible de faire un lien entre l’alimentation et la place de l’individu en s’appuyant sur d’autres ressources archéologiques<ref>{{Article|langue=fr|prénom1=Estelle|nom1=Herrscher|prénom2=Hervé|nom2=Bocherens|prénom3=Frédérique|nom3=Valentin|prénom4=Renée|nom4=Colardelle|titre=Comportements alimentaires au Moyen Âge à Grenoble : application de la biogéochimie isotopique à la nécropole Saint-Laurent ({{sp-|XIII|-|XV|s}}, Isère, France)|périodique=Comptes Rendus de l'Académie des Sciences - Series III - Sciences de la Vie|volume=324|numéro=5|pages=479–487|date=2001-05|doi=10.1016/S0764-4469(01)01316-6|lire en ligne=https://linkinghub.elsevier.com/retrieve/pii/S0764446901013166|consulté le=2023-12-10}}</ref>. |
|||
L’analyse isotopique est l’une des méthodes les plus utilisées en [[archéologie]] à ce jour. Elle est utilisée entre autres à Grenoble au [[musée archéologique Saint-Laurent]]. Ce lieu n'est pas un simple musée puisque des recherches en archéologie sont encore en cours. En complément de cette méthode utilisant des isotopes, on peut s’appuyer sur l’usure dentaire et la présence de caries<ref name=":1" />. |
|||
En archéologie, l’analyse isotopique consiste à déterminer après extraction du collagène d’ossements et de dents fossilisées différents [[Rapport isotopique|rapports isotopiques]] : [[Carbone 13|<sup>13</sup>C]]/[[Carbone 14|<sup>14</sup>C]], [[Carbone 13|<sup>13</sup>C]]/[[Azote 15|<sup>15</sup>N]], [[Azote 15|<sup>15</sup>N]]/[[Azote 14|<sup>14</sup>N]], [[Strontium 87|<sup>87</sup>Sr]]/[[Strontium 86|<sup>86</sup>Sr]] , [[Strontium|Sr]]/[[Calcium|Ca]], [[Oxygène 18|<sup>18</sup>O]]/[[Oxygène 16|<sup>16</sup>O]]. Elle est également utilisée pour étudier des tissus humains tels que les cheveux et la peau, remarquablement conservés dans des milieux humides, désertiques ou gelés<ref name=":2">{{Ouvrage|langue=fr|prénom1=François|nom1=Djindjian|titre=Manuel d'archéologie|éditeur=Armand Colin|date=2011|isbn=978-2-200-26676-9|doi=10.3917/arco.djind.2011.01|lire en ligne=http://www.cairn.info/manuel-d-archeologie--9782200266769.htm|consulté le=2023-12-10}}</ref>. L’analyse du rapport [[Carbone 13|<sup>13</sup>C]]/[[Carbone 14|<sup>14</sup>C]], plus connue sous le nom la [[Datation par le carbone 14|datation par carbone 14]], et l’analyse du rapport [[Strontium 87|<sup>87</sup>Sr]]/[[Strontium 86|<sup>86</sup>Sr]] donne accès à l’âge des échantillons. L’analyse des rapports [[Carbone 13|<sup>13</sup>C]]/[[Azote 15|<sup>15</sup>N]], [[Azote 15|<sup>15</sup>N]]/[[Azote 14|<sup>14</sup>N]], [[Strontium|Sr]]/[[Calcium|Ca]] permettent quant à eux d’en apprendre plus sur le régime alimentaire associé aux échantillons retrouvés. Plus particulièrement, le rapport [[Carbone 13|<sup>13</sup>C]]/[[Azote 15|<sup>15</sup>N]] permet de distinguer les régimes alimentaires des carnivores aux herbivores et met en lumière la consommation de certaines plantes telles que les plantes marines, de climat tempéré ou tropical<ref name=":2" />. |
|||
=== Séparation des isotopes par centrifugation === |
=== Séparation des isotopes par centrifugation === |
||
| Ligne 82 : | Ligne 91 : | ||
La centrifugation se réalise dans une [[Procédé en cascade|cascade]] de centrifugeuses qui élèvent petit à petit le taux de [[Uranium 235|{{exp|235}}U]] dans le mélange {{exp|235}}U-[[Uranium 238|{{exp|238}}U]], pour des applications civiles (enrichissement de 5 %) ou militaires (90 %). |
La centrifugation se réalise dans une [[Procédé en cascade|cascade]] de centrifugeuses qui élèvent petit à petit le taux de [[Uranium 235|{{exp|235}}U]] dans le mélange {{exp|235}}U-[[Uranium 238|{{exp|238}}U]], pour des applications civiles (enrichissement de 5 %) ou militaires (90 %). |
||
Les [[centrifugeuse]]s sont des cylindres étroits tournant à vitesse élevée. La force centrifuge est égale à ''M''.ω{{exp|2}}.''r'' où ''M'' est la masse unitaire, ω la [[vitesse angulaire]] de rotation et ''r'' le rayon du cylindre. Pour éviter une rupture mécanique, on choisit ''r'' petit et, afin d'avoir une force appréciable, on choisit ω très élevée (la force est proportionnelle au [[Carré (algèbre)|carré]] de la vitesse de rotation). Le taux d'enrichissement recherché est obtenu en disposant une quantité importante de centrifugeuses en série (des milliers). Ce mode de séparation est utilisé par des industriels canadiens, russes, européens. |
Les [[centrifugeuse]]s sont des cylindres étroits tournant à vitesse élevée. La [[force centrifuge]] est égale à ''M''.ω{{exp|2}}.''r'' où ''M'' est la masse unitaire, ω la [[vitesse angulaire]] de rotation et ''r'' le rayon du cylindre. Pour éviter une rupture mécanique, on choisit ''r'' petit et, afin d'avoir une force appréciable, on choisit ω très élevée (la force est proportionnelle au [[Carré (algèbre)|carré]] de la vitesse de rotation). Le taux d'enrichissement recherché est obtenu en disposant une quantité importante de centrifugeuses en série (des milliers). Ce mode de séparation est utilisé par des industriels canadiens, russes, européens. |
||
== Manipulation et observation d'isotopes sous microscopie électronique == |
|||
Une expérience permettant la mesure de vibrations atomiques dans un [[microscope électronique]] a été décrite en [[2022]]. Il devient possible d'identifier les isotopes chimiques à une échelle sub-nanométrique. Ceci devrait permettre, à cette résolution, de construire et suivre des domaines isotopiques<ref>{{Article |langue=en |prénom1=Jordan A. |nom1=Hachtel |titre=Isotopes tracked on a sub-nanometre scale using electron spectroscopy |périodique=Nature |volume=603 |numéro=7899 |date=2022-03 |doi=10.1038/d41586-022-00545-1 |lire en ligne=https://www.nature.com/articles/d41586-022-00545-1 |consulté le=2022-03-11 |pages=36–37}}.</ref>. |
|||
== Table des isotopes== |
== Table des isotopes == |
||
{{boîte déroulante/début|alignT=center|titre=Table des isotopes}} |
{{boîte déroulante/début|alignT=center|titre=Table des isotopes}} |
||
{{Table des isotopes}} |
{{Table des isotopes}} |
||
| Ligne 100 : | Ligne 112 : | ||
=== Articles connexes === |
=== Articles connexes === |
||
{{colonnes | nombre = 3 | taille = |
{{colonnes | nombre = 3 | taille = 15 | |
||
* [[Isobare (chimie)]] |
* [[Isobare (chimie)]] |
||
* [[Isotone]] |
* [[Isotone]] |
||
| Ligne 106 : | Ligne 118 : | ||
* [[Période radioactive]] |
* [[Période radioactive]] |
||
* [[Radioactivité]] |
* [[Radioactivité]] |
||
* [[ |
* [[Noyau exotique]] |
||
* [[Table des isotopes]] |
* [[Table des isotopes]] |
||
* [[Isotope stable]] |
* [[Isotope stable]] |
||
| Ligne 123 : | Ligne 135 : | ||
{{Tableau périodique des isotopes (navigation)}} |
{{Tableau périodique des isotopes (navigation)}} |
||
{{Portail| |
{{Portail|physique|chimie}} |
||
[[Catégorie:Isotope]] |
[[Catégorie:Isotope|*]] |
||
[[Catégorie:Classification chimique]] |
[[Catégorie:Classification chimique]] |
||
[[Catégorie:Physique nucléaire]] |
[[Catégorie:Physique nucléaire]] |
||
Dernière version du 29 février 2024 à 12:26

Deux nucléides d'un même élément chimique sont dits isotopes s'ils partagent le même nombre de protons, Z, mais ont des nombres différents de neutrons, N[1].
Par extension, un isotope est une classe d'atomes caractérisée par son nombre de protons Z et son nombre de neutrons N[2], sans distinction concernant le spin ou l'état énergétique.
Contexte — En physique nucléaire et en chimie, chaque noyau d'atome ou nucléide est défini par son nombre de protons Z (appelé aussi numéro atomique, qui définit d'ailleurs le type d'élément chimique), son nombre de neutrons N, son spin s et son niveau énergétique.
Les isotopes ne doivent pas être confondus avec :
- les isotones, nucléides ayant le même nombre de neutrons mais un nombre de protons différent (Z ≠ Z' mais N = N') ;
- les isobares, nucléides ayant des nombres de protons différents, des nombres de neutrons différents, mais des nombres de masse identiques (Z ≠ Z', N ≠ N', mais Z + N = A = A' = Z' + N') ;
- les isomères, nucléides ayant le même nombre de protons Z et le même nombre de neutrons N (donc aussi le même nombre de masse A), mais pas le même spin ni le même niveau énergétique.
Notation[modifier | modifier le code]
Chaque isotope est représenté par un symbole A
ZM composé de :
- son symbole chimique M (H, He, Li, etc.) ;
- son nombre de masse A (égal au nombre de nucléons de l'atome), placé en haut et à gauche du symbole chimique ;
- son numéro atomique Z (égal au nombre de protons), placé en bas et à gauche du symbole chimique.
Le carbone 12 et le carbone 14, deux isotopes de l'élément carbone, sont ainsi notés 12
6C et 14
6C. Le numéro atomique est souvent omis, car redondant avec le symbole chimique[a] : 12C et 14C, par exemple.
On peut également représenter les isotopes par leur nom suivi de leur nombre de masse séparé par une espace (et non un tiret, contrairement à l'anglais) : carbone 14, oxygène 18, fer 56, etc.
Cas particulier de l'hydrogène : les isotopes les plus courants de l'hydrogène sont normalement notés 1H (protium), 2H (deutérium) et 3H (tritium), mais l'IUPAC admet aussi (sans toutefois le recommander) l'usage des symboles D et T pour le deutérium et le tritium[b], en raison de l'effet isotopique marqué de ces isotopes par rapport au protium.
Propriétés[modifier | modifier le code]
Les propriétés des atomes étant essentiellement régies par leurs cortèges électroniques, les isotopes d'un même élément chimique ont essentiellement les mêmes propriétés physiques et chimiques, qualitativement et quantitativement[c]. La différence de masse entre isotopes, parce qu'elle affecte l'énergie cinétique des atomes et des molécules, entraîne cependant de légères différences de propriétés, appelées effets isotopiques. Ces effets sont d'autant plus importants que la différence relative de masse est grande ; ils sont donc maximaux pour l'hydrogène (la masse de 2H est le double de celle de 1H) et minimaux pour les éléments les plus lourds (la masse de 235U, par exemple, n'est supérieure à celle de 234U que de 0,4 %).
- Un premier effet concerne les propriétés à l'équilibre. Quand dans un corps simple on remplace un atome par un isotope plus lourd, on augmente notamment, mais légèrement, les températures de fusion et d'ébullition, ainsi que les chaleurs latentes correspondantes (de fusion et de vaporisation). Leurs valeurs sont ainsi de 3,81 °C, 101,42 °C, 6,132 kJ/mol et 41,521 kJ/mol pour l'eau lourde 2H216O, contre 0 °C, 100 °C, 6,007 kJ/mol et 40,657 kJ/mol pour l'eau légère 1H216O.
- Un second effet concerne la vitesse des processus de retour à l'équilibre (écoulement, diffusion, réactions chimiques, etc.). Quand dans un corps simple on remplace un atome par un isotope plus lourd, toutes ces vitesses sont diminuées. La viscosité de l'eau à 20 °C est ainsi de 1,246 7 × 10−3 Pa s pour l'eau lourde, contre 1,001 6 × 10−3 Pa s pour l'eau légère.
Ces effets sont mis à profit pour séparer les isotopes (pour la recherche, la médecine et l'industrie nucléaire, notamment). Les températures d'ébullition légèrement différentes ont par exemple permis les premiers enrichissements isotopiques par distillation à l'aide d'une colonne de distillation à bande tournante[3]. L'enrichissement en 235U de l'uranium naturel se fait aujourd'hui par diffusion thermique, diffusion à l'état gazeux, centrifugation ou séparation électromagnétique.
Stabilité[modifier | modifier le code]
Il existe 80 éléments chimiques ayant au moins un isotope stable, de l'hydrogène 1H au plomb 82Pb (81 éléments si l'on inclut le bismuth 83Bi[d]). Le technétium 43Tc, le prométhium 61Pm et tous les éléments de numéro atomique supérieur à 83 n'ont, quant à eux, aucun isotope stable.
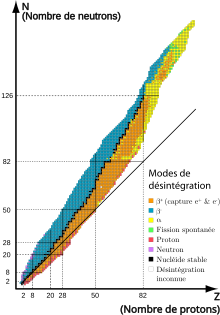
Le noyau d'un atome est constitué d'une part de protons qui se repoussent sous l'action de l'interaction électromagnétique (les charges électriques de même nature se repoussent) mais qui s'attirent sous l'action de l'interaction forte. Dans un noyau, la stabilité est donc assurée par l'interaction forte, et par les neutrons qui, éloignant les protons les uns des autres, diminuent l'intensité de la répulsion électromagnétique entre les protons, d'où les propriétés suivantes :
Pour ces centaines d'isotopes naturels, les nombres respectifs de protons et de neutrons semblent respecter certaines règles :
- le nombre de neutrons est à peu près égal à celui des protons pour les éléments légers ; à partir du 21Sc, le nombre de neutrons devient supérieur au nombre de protons, l'excédent dépassant 50 % pour les éléments les plus lourds ;
- certains noyaux particulièrement stables contiennent des protons ou des neutrons (ou les deux) en nombre égal à un des « nombres magiques » suivants : 2, 8, 20, 28, 50, 82, 126.Selon les théories actuelles, ces valeurs correspondraient à des noyaux possédant des couches complètes de neutrons ou de protons ;
- les éléments de nombre Z impair possèdent moins d'isotopes stables que les éléments de nombre Z pair.
Il existe des milliers de noyaux instables, de durée de vie très courte (jusqu'à 10−23 seconde), qui ne peuvent être produits qu'en laboratoire. On les qualifie de noyaux exotiques, notamment en raison de leurs propriétés spécifiques (grandes déformations, halos de neutron, etc.).
Utilisations[modifier | modifier le code]
Analyse isotopique[modifier | modifier le code]
Un exemple très connu de couple d'isotopes est constitué par le carbone : le carbone est présent en grande majorité sous son isotope de masse atomique 12 (le « carbone 12 ») ; d'autre part, on peut trouver en faible quantité l'isotope de masse atomique 14 (le carbone 14), qui est chimiquement strictement équivalent au carbone 12, mais qui est radioactif. En effet, les neutrons supplémentaires du noyau rendent l'atome instable. Il se désintègre en donnant de l'azote 14 et en émettant un rayonnement bêta.
- Le rapport 18O/16O (par exemple dans les apatites des fossiles de vertébrés) permet, dans une certaine mesure, de reconstituer certains paléoclimats[4] ;
- Dans le domaine médical (médecine légale, médecine du travail, toxicologie, etc.) l'analyse isotopique permet de différencier diverses sources de contamination, et souvent d'identifier ainsi la source d'une intoxication[5].
- Dans le domaine de l'évaluation environnementale, l'analyse isotopique d'un organisme, du sol ou de sédiments permet de différencier la partie naturelle de la part anthropique d'une contamination par certains métaux, dont le plomb[6]. Sur la base de signatures isotopiques particulières, on peut distinguer le plomb de céramiques, du plomb issu de la combustion du charbon et de l'essence[6]. On peut ainsi tracer l'origine d'une pollution actuelle ou passée (déposée dans les sédiments). On a ainsi pu montrer que dans la Baie de San Simón (partie intérieure de la Ría de Vigo située au nord-ouest de l'Espagne), selon les époques, l'homme a été responsable de 25 à 98 % des apports de plomb trouvé dans les échantillons de la zone intertidale, et de 9 à 84 % dans les échantillons subtidaux. Les variations temporelles observées dans les carottes de sédiments ont pu être reliées, d'abord aux retombées de fumées de combustion de charbon (60 à 70 % du plomb de la baie) avant la création d'une usine de céramique dans la région (dans les années 1970), qui est alors devenue la principale source de plomb (de 95 à 100 % des apports), avant qu'une nouvelle source soit dominante : l'essence plombée[6]. L'histoire des immiscions de plomb dans l'environnement de cette baie a pu être ainsi déterminée pour tout le XXe siècle, et même pour le XIXe siècle pour la zone subtidale[6].
- L'analyse isotopique est utilisée dans les études du réseau trophique. En effet, les consommateurs présentent une signature isotopique directement reliée à celle de leurs aliments (elle en diffère peu, et suivant une loi connue). En analysant les rapports isotopiques d'un consommateur et de ses aliments potentiels, il est possible de reconstituer le régime probable du consommateur[7].
- La lutte contre les fraudes utilise la précision de ces analyses pour élucider des responsabilités criminelles (détermination de la marque d'une cartouche de chasse ou origine d'une balle à partir d'un échantillon de plomb) ou de fraudes alimentaires[8] (par exemple l'analyse des rapports isotopiques stables (13C/12C et 15N/14N) d'échantillons de viande d'agneau (mesurée par spectrométrie de masse isotopique) permet de confirmer ou infirmer une origine géographique, ou même de savoir si l'animal a uniquement tété le lait de sa mère, ou reçu des supplémentations solides (maïs, soja…) ou été nourri d'herbe naturelle[8]…
Ces analyses permettent aussi de différencier certains types d'agneau, mais aussi de vin, de jus de fruits, de miel[8] ou de produits laitiers et fromages (dont AOC par exemple[9]).
Un simple échantillon haché solide suffit et permet d'acquérir l'information pour un grand nombre de métabolites (acides aminés, acides gras, sucres, etc.)[10].
L'analyse isotopique en archéologie[modifier | modifier le code]
Depuis les années 90, l’archéologie a connu de nombreuses avancées en termes de techniques d’analyse, ce qui a non seulement permis de dater des échantillons, mais aussi d’obtenir des informations sur l’alimentation des populations animales et humaines[11]. Il est donc possible de savoir quel régime alimentaire a été suivi par un individu à une époque et à une localisation donnée et ce à différents moments de sa vie selon le tissu squelettique étudié[12]. En effet, la composition chimique des ossements dépend en partie des aliments consommés durant la vie et plus généralement de l’environnement de vie[11]. Avec ces informations, il est possible de faire un lien entre l’alimentation et la place de l’individu en s’appuyant sur d’autres ressources archéologiques[13].
L’analyse isotopique est l’une des méthodes les plus utilisées en archéologie à ce jour. Elle est utilisée entre autres à Grenoble au musée archéologique Saint-Laurent. Ce lieu n'est pas un simple musée puisque des recherches en archéologie sont encore en cours. En complément de cette méthode utilisant des isotopes, on peut s’appuyer sur l’usure dentaire et la présence de caries[12].
En archéologie, l’analyse isotopique consiste à déterminer après extraction du collagène d’ossements et de dents fossilisées différents rapports isotopiques : 13C/14C, 13C/15N, 15N/14N, 87Sr/86Sr , Sr/Ca, 18O/16O. Elle est également utilisée pour étudier des tissus humains tels que les cheveux et la peau, remarquablement conservés dans des milieux humides, désertiques ou gelés[14]. L’analyse du rapport 13C/14C, plus connue sous le nom la datation par carbone 14, et l’analyse du rapport 87Sr/86Sr donne accès à l’âge des échantillons. L’analyse des rapports 13C/15N, 15N/14N, Sr/Ca permettent quant à eux d’en apprendre plus sur le régime alimentaire associé aux échantillons retrouvés. Plus particulièrement, le rapport 13C/15N permet de distinguer les régimes alimentaires des carnivores aux herbivores et met en lumière la consommation de certaines plantes telles que les plantes marines, de climat tempéré ou tropical[14].
Séparation des isotopes par centrifugation[modifier | modifier le code]
La proportion de l'isotope stable par rapport à l'isotope instable est la même dans l'atmosphère et dans les tissus des êtres vivants, mais elle varie régulièrement au cours du temps à la mort de l'individu, puisque les échanges sont stoppés. C'est sur cette variation que se base la plus connue des méthodes de datation radioactive par couple d'isotopes, qui est la méthode de datation par le carbone 14. C'est certainement l'application la plus importante du concept d'isotope. Les traceurs isotopiques sont une autre application de ce concept.
Une application majeure est la séparation des isotopes 235U et 238U de l'uranium, aussi appelé enrichissement ; cette séparation est obtenue par diffusion gazeuse ou par centrifugation d'hexafluorure d'uranium UF6.
La centrifugation se réalise dans une cascade de centrifugeuses qui élèvent petit à petit le taux de 235U dans le mélange 235U-238U, pour des applications civiles (enrichissement de 5 %) ou militaires (90 %).
Les centrifugeuses sont des cylindres étroits tournant à vitesse élevée. La force centrifuge est égale à M.ω2.r où M est la masse unitaire, ω la vitesse angulaire de rotation et r le rayon du cylindre. Pour éviter une rupture mécanique, on choisit r petit et, afin d'avoir une force appréciable, on choisit ω très élevée (la force est proportionnelle au carré de la vitesse de rotation). Le taux d'enrichissement recherché est obtenu en disposant une quantité importante de centrifugeuses en série (des milliers). Ce mode de séparation est utilisé par des industriels canadiens, russes, européens.
Manipulation et observation d'isotopes sous microscopie électronique[modifier | modifier le code]
Une expérience permettant la mesure de vibrations atomiques dans un microscope électronique a été décrite en 2022. Il devient possible d'identifier les isotopes chimiques à une échelle sub-nanométrique. Ceci devrait permettre, à cette résolution, de construire et suivre des domaines isotopiques[15].
Table des isotopes[modifier | modifier le code]
Les demi-vies sont indiquées par la couleur de la cellule de chaque isotope ; les isotopes ayant deux modes de désintégration qui diffèrent par leur demi-vie ont des couleurs de fond et de bordure différentes.
| Él | Instable | Simplement listés mais non détaillés |
| Él | 1-10 jours | |
| Él | 10-100 jours | |
| Él | 100 jours - 10 années | |
| Él | 10-10 000 années | |
| Él | >10 000 années | |
| Él | Radioélément naturel. Période < 1012 a | |
| Él | Stable. Période > 1012 a | Couleur de fond grise et bordure ocre si le radionucléide est présent dans la nature |
| p | 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H | 2 | 3 | 4 | 5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| n | H | He | Li | Be | B | 6 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1 | D | 3He | 4Li | 5Be | 6B | C | 7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2 | T | 4He | 5Li | 6Be | 7B | 8C | N | 8 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3 | 4H | 5He | 6Li | 7Be | 8B | 9C | 10N | O | 9 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4 | 5H | 6He | 7Li | 8Be | 9B | 10C | 11N | 12O | F | 10 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5 | 6H | 7He | 8Li | 9Be | 10B | 11C | 12N | 13O | 14F | Ne | 11 | 12 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 6 | 7H | 8He | 9Li | 10Be | 11B | 12C | 13N | 14O | 15F | 16Ne | Na | Mg | 13 | 14 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 7 | 9He | 10Li | 11Be | 12B | 13C | 14N | 15O | 16F | 17Ne | 18Na | 19Mg | Al | Si | 15 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 8 | 10He | 11Li | 12Be | 13B | 14C | 15N | 16O | 17F | 18Ne | 19Na | 20Mg | 21Al | 22Si | P | 16 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 9 | 12Li | 13Be | 14B | 15C | 16N | 17O | 18F | 19Ne | 20Na | 21Mg | 22Al | 23Si | 24P | S | 17 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 10 | 14Be | 15B | 16C | 17N | 18O | 19F | 20Ne | 21Na | 22Mg | 23Al | 24Si | 25P | 26S | Cl | 18 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 11 | 15Be | 16B | 17C | 18N | 19O | 20F | 21Ne | 22Na | 23Mg | 24Al | 25Si | 26P | 27S | 28Cl | Ar | 19 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 12 | 16Be | 17B | 18C | 19N | 20O | 21F | 22Ne | 23Na | 24Mg | 25Al | 26Si | 27P | 28S | 29Cl | 30Ar | K | 20 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 13 | 18B | 19C | 20N | 21O | 22F | 23Ne | 24Na | 25Mg | 26Al
|
27Si | 28P | 29S | 30Cl | 31Ar | 32K | Ca | 21 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 14 | 19B | 20C | 21N | 22O | 23F | 24Ne | 25Na | 26Mg | 27Al | 28Si | 29P | 30S | 31Cl | 32Ar | 33K | 34Ca | Sc | 22 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 15 | 21C | 22N | 23O | 24F | 25Ne | 26Na | 27Mg | 28Al | 29Si | 30P | 31S | 32Cl | 33Ar | 34K | 35Ca | 36Sc | Ti | 23 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 16 | 22C | 23N | 24O | 25F | 26Ne | 27Na | 28Mg | 29Al | 30Si | 31P | 32S | 33Cl | 34Ar | 35K | 36Ca | 37Sc | 38Ti | V | 24 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 17 | 24N | 25O | 26F | 27Ne | 28Na | 29Mg | 30Al | 31Si | 32P | 33S | 34Cl | 35Ar | 36K | 37Ca | 38Sc | 39Ti | 40V | Cr | 25 | 26 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 18 | 25N | 26O | 27F | 28Ne | 29Na | 30Mg | 31Al | 32Si | 33P | 34S | 35Cl | 36Ar | 37K | 38Ca | 39Sc | 40Ti | 41V | 42Cr | Mn | Fe | 27 | 28 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 19 | 27O | 28F | 29Ne | 30Na | 31Mg | 32Al | 33Si | 34P | 35S | 36Cl | 37Ar | 38K | 39Ca | 40Sc | 41Ti | 42V | 43Cr | 44Mn | 45Fe | Co | Ni | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 20 | 28O | 29F | 30Ne | 31Na | 32Mg | 33Al | 34Si | 35P | 36S | 37Cl | 38Ar | 39K | 40Ca | 41Sc | 42Ti | 43V | 44Cr | 45Mn | 46Fe | 47Co | 48Ni | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 21 | 30F | 31Ne | 32Na | 33Mg | 34Al | 35Si | 36P | 37S | 38Cl | 39Ar | 40K | 41Ca | 42Sc | 43Ti | 44V | 45Cr | 46Mn | 47Fe | 48Co | 49Ni | 29 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 22 | 31F | 32Ne | 33Na | 34Mg | 35Al | 36Si | 37P | 38S | 39Cl | 40Ar | 41K | 42Ca | 43Sc | 44Ti | 45V | 46Cr | 47Mn | 48Fe | 49Co | 50Ni | Cu | 30 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 23 | 33Ne | 34Na | 35Mg | 36Al | 37Si | 38P | 39S | 40Cl | 41Ar | 42K | 43Ca | 44Sc | 45Ti | 46V | 47Cr | 48Mn | 49Fe | 50Co | 51Ni | 52Cu | Zn | 31 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 24 | 34Ne | 35Na | 36Mg | 37Al | 38Si | 39P | 40S | 41Cl | 42Ar | 43K | 44Ca | 45Sc | 46Ti | 47V | 48Cr | 49Mn | 50Fe | 51Co | 52Ni | 53Cu | 54Zn | Ga | 32 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 25 | 36Na | 37Mg | 38Al | 39Si | 40P | 41S | 42Cl | 43Ar | 44K | 45Ca | 46Sc
|
47Ti | 48V | 49Cr | 50Mn | 51Fe | 52Co | 53Ni | 54Cu | 55Zn | 56Ga | Ge | 33 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 26 | 37Na | 38Mg | 39Al | 40Si | 41P | 42S | 43Cl | 44Ar | 45K | 46Ca | 47Sc | 48Ti | 49V | 50Cr | 51Mn | 52Fe | 53Co | 54Ni | 55Cu | 56Zn | 57Ga | 58Ge | As | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 27 | 39Mg | 40Al | 41Si | 42P | 43S | 44Cl | 45Ar | 46K | 47Ca | 48Sc | 49Ti | 50V
|
51Cr | 52Mn
|
53Fe | 54Co | 55Ni | 56Cu | 57Zn | 58Ga | 59Ge | 60As | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 28 | 40Mg | 41Al | 42Si | 43P | 44S | 45Cl | 46Ar | 47K | 48Ca | 49Sc | 50Ti | 51V | 52Cr | 53Mn | 54Fe | 55Co | 56Ni | 57Cu | 58Zn | 59Ga | 60Ge | 61As | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 29 | 42Al | 43Si | 44P | 45S | 46Cl | 47Ar | 48K | 49Ca | 50Sc | 51Ti | 52V | 53Cr | 54Mn | 55Fe | 56Co | 57Ni | 58Cu | 59Zn | 60Ga | 61Ge | 62As | 34 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 30 | 44Si | 45P | 46S | 47Cl | 48Ar | 49K | 50Ca | 51Sc | 52Ti | 53V | 54Cr | 55Mn | 56Fe | 57Co | 58Ni | 59Cu | 60Zn | 61Ga | 62Ge | 63As | Se | 35 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 31 | 46P | 47S | 48Cl | 49Ar | 50K | 51Ca | 52Sc | 53Ti | 54V | 55Cr | 56Mn | 57Fe | 58Co
|
59Ni | 60Cu | 61Zn | 62Ga | 63Ge | 64As | 65Se | Br | 36 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 32 | 48S | 49Cl | 50Ar | 51K | 52Ca | 53Sc | 54Ti | 55V | 56Cr | 57Mn | 58Fe | 59Co | 60Ni | 61Cu | 62Zn | 63Ga | 64Ge | 65As | 66Se | 67Br | Kr | 37 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 33 | 49S | 50Cl | 51Ar | 52K | 53Ca | 54Sc | 55Ti | 56V | 57Cr | 58Mn | 59Fe | 60Co
|
61Ni | 62Cu | 63Zn | 64Ga | 65Ge | 66As | 67Se | 68Br | 69Kr | Rb | 38 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 34 | 51Cl | 52Ar | 53K | 54Ca | 55Sc | 56Ti | 57V | 58Cr | 59Mn | 60Fe | 61Co | 62Ni | 63Cu | 64Zn | 65Ga | 66Ge | 67As | 68Se | 69Br | 70Kr | 71Rb | Sr | 39 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 35 | 53Ar | 54K | 55Ca | 56Sc | 57Ti | 58V | 59Cr | 60Mn | 61Fe | 62Co | 63Ni | 64Cu | 65Zn | 66Ga | 67Ge | 68As | 69Se | 70Br | 71Kr | 72Rb | Y | 40 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 36 | 55K | 56Ca | 57Sc | 58Ti | 59V | 60Cr | 61Mn | 62Fe | 63Co | 64Ni | 65Cu | 66Zn | 67Ga | 68Ge | 69As | 70Se | 71Br | 72Kr | 73Rb | Zr | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 37 | 57Ca | 58Sc | 59Ti | 60V | 61Cr | 62Mn | 63Fe | 64Co | 65Ni | 66Cu | 67Zn | 68Ga | 69Ge | 70As | 71Se | 72Br | 73Kr | 74Rb | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 38 | 59Sc | 60Ti | 61V | 62Cr | 63Mn | 64Fe | 65Co | 66Ni | 67Cu | 68Zn | 69Ga | 70Ge | 71As | 72Se | 73Br | 74Kr | 75Rb | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 39 | 60Sc | 61Ti | 62V | 63Cr | 64Mn | 65Fe | 66Co | 67Ni | 68Cu | 69Zn | 70Ga | 71Ge
|
72As | 73Se | 74Br | 75Kr | 76Rb | 77Sr | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 40 | 62Ti | 63V | 64Cr | 65Mn | 66Fe | 67Co | 68Ni | 69Cu | 70Zn | 71Ga | 72Ge | 73As | 74Se | 75Br | 76Kr | 77Rb | 78Sr | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 41 | 63Ti | 64V | 65Cr | 66Mn | 67Fe | 68Co | 69Ni | 70Cu | 71Zn | 72Ga | 73Ge | 74As | 75Se | 76Br | 77Kr | 78Rb | 79Sr | 81Zr | 41 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 42 | 65V | 66Cr | 67Mn | 68Fe | 69Co | 70Ni | 71Cu | 72Zn | 73Ga | 74Ge | 75As | 76Se | 77Br
|
78Kr | 79Rb | 80Sr | 81Y | 82Zr | Nb | 42 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 43 | 67Cr | 68Mn | 69Fe | 70Co | 71Ni | 72Cu | 73Zn | 74Ga | 75Ge | 76As | 77Se
|
78Br | 79Kr
|
80Rb | 81Sr | 82Y | 83Zr | 84Nb | Mo | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 44 | 69Mn | 70Fe | 71Co | 72Ni | 73Cu | 74Zn | 75Ga | 76Ge | 77As | 78Se | 79Br
|
80Kr | 81Rb | 82Sr | 83Y | 84Zr | 43 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 45 | 71Fe | 72Co | 73Ni | 74Cu | 75Zn | 76Ga | 77Ge | 78As | 79Se
|
80Br | 81Kr
|
82Rb | 83Sr
|
84Y | 85Zr | 86Nb | 87Mo | Tc | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 46 | 72Fe | 73Co | 74Ni | 75Cu | 76Zn | 77Ga | 78Ge | 79As | 80Se | 81Br | 82Kr | 83Rb | 84Sr | 85Y | 86Zr | 87Nb | 88Mo | 44 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 47 | 74Co | 75Ni | 76Cu | 77Zn | 78Ga | 79Ge | 80As | 81Se | 82Br
|
83Kr | 84Rb
|
85Sr
|
86Y | 87Zr | 88Nb | 89Mo | 90Tc | Ru | 45 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 48 | 75Co | 76Ni | 77Cu | 78Zn | 79Ga | 80Ge | 81As | 82Se | 83Br | 84Kr | 85Rb | 86Sr | 87Y
|
88Zr | 89Nb | 90Mo | 91Tc | 92Ru | Rh | 46 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 49 | 77Ni | 78Cu | 79Zn | 80Ga | 81Ge | 82As | 83Se | 84Br | 85Kr
|
86Rb
|
87Sr
|
88Y
|
89Zr
|
90Nb | 91Mo | 92Tc | 93Ru | Pd | 47 | 48 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 50 | 78Ni | 79Cu | 80Zn | 81Ga | 82Ge | 83As | 84Se | 85Br | 86Kr | 87Rb | 88Sr | 89Y
|
90Zr
|
91Nb
|
92Mo | 93Tc | 94Ru | 95Rh | Ag | Cd | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 51 | 80Cu | 81Zn | 82Ga | 83Ge | 84As | 85Se | 86Br | 87Kr | 88Rb | 89Sr | 90Y
|
91Zr | 92Nb
|
93Mo
|
94Tc | 95Ru | 96Rh | 97Pd | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 52 | 82Zn | 83Ga | 84Ge | 85As | 86Se | 87Br | 88Kr | 89Rb | 90Sr | 91Y
|
92Zr | 93Nb
|
94Mo | 95Tc
|
96Ru | 97Rh | 98Pd | 99Ag | 100Cd | 49 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 53 | 83Zn | 84Ga | 85Ge | 86As | 87Se | 88Br | 89Kr | 90Rb | 91Sr | 92Y | 93Zr | 94Nb
|
95Mo | 96Tc
|
97Ru | 98Rh | 99Pd | 100Ag | 101Cd | In | 50 | 51 | 52 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 54 | 85Ga | 86Ge | 87As | 88Se | 89Br | 90Kr | 91Rb | 92Sr | 93Y | 94Zr | 95Nb
|
96Mo | 97Tc
|
98Ru | 99Rh
|
100Pd | 101Ag | 102Cd | Sn | Sb | Te | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 55 | 86Ga | 87Ge | 88As | 89Se | 90Br | 91Kr | 92Rb | 93Sr | 94Y | 95Zr | 96Nb | 97Mo | 98Tc | 99Ru | 100Rh | 101Pd | 102Ag | 103Cd | 104In | 107Te | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 56 | 88Ge | 89As | 90Se | 91Br | 92Kr | 93Rb | 94Sr | 95Y | 96Zr | 97Nb | 98Mo | 99Tc
|
100Ru | 101Rh
|
102Pd | 103Ag | 104Cd | 105In | 108Te | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 57 | 89Ge | 90As | 91Se | 92Br | 93Kr | 94Rb | 95Sr | 96Y | 97Zr | 98Nb | 99Mo | 100Tc | 101Ru | 102Rh | 103Pd | 104Ag | 105Cd | 106In | 107Sn | 109Te | 53 | 54 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 58 | 91As | 92Se | 93Br | 94Kr | 95Rb | 96Sr | 97Y | 98Zr | 99Nb | 100Mo | 101Tc | 102Ru | 103Rh
|
104Pd | 105Ag
|
106Cd | 107In | 108Sn | I | Xe | 55 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 59 | 92As | 93Se | 94Br | 95Kr | 96Rb | 97Sr | 98Y | 99Zr | 100Nb | 101Mo | 102Tc | 103Ru | 104Rh | 105Pd | 106Ag
|
107Cd | 108In | 109Sn | 110Sb | 111Te | 113Xe | Cs | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 60 | 94Se | 95Br | 96Kr | 97Rb | 98Sr | 99Y | 100Zr | 101Nb | 102Mo | 103Tc | 104Ru | 105Rh
|
106Pd | 107Ag
|
108Cd | 109In | 110Sn | 111Sb | 112Te | 113I | 114Xe | 56 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 61 | 96Br | 97Kr | 98Rb | 99Sr | 100Y | 101Zr | 102Nb | 103Mo | 104Tc | 105Ru | 106Rh | 107Pd
|
108Ag
|
109Cd | 110In | 111Sn | 112Sb | 113Te | 114I | 115Xe | 116Cs | Ba | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 62 | 97Br | 98Kr | 99Rb | 102Zr | 103Nb | 104Mo | 105Tc | 106Ru | 107Rh | 108Pd | 109Ag
|
110Cd | 111In
|
112Sn | 113Sb | 114Te | 115I | 116Xe | 117Cs | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 63 | 99Kr | 102Y | 104Nb | 105Mo | 106Tc | 107Ru | 108Rh | 109Pd | 110Ag
|
111Cd
|
112In | 113Sn
|
114Sb | 115Te | 116I | 117Xe | 118Cs | 119Ba | 57 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 64 | 100Kr | 105Nb | 106Mo | 107Tc | 108Ru | 109Rh | 110Pd | 111Ag
|
112Cd | 113In
|
114Sn | 115Sb | 116Te | 117I | 118Xe | 119Cs | La | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 65 | 106Nb | 107Mo | 108Tc | 109Ru | 110Rh | 111Pd | 112Ag | 113Cd
|
114In
|
115Sn | 116Sb | 117Te | 118I | 119Xe | 120Cs | 121Ba | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 66 | 108Mo | 109Tc | 110Ru | 111Rh | 112Pd | 113Ag | 114Cd | 115In
|
116Sn | 117Sb | 118Te | 119I | 120Xe | 121Cs | 122Ba | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 67 | 110Tc | 111Ru | 112Rh | 113Pd | 114Ag | 115Cd
|
116In | 117Sn
|
118Sb | 119Te
|
120I | 121Xe | 122Cs | 123Ba | 58 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 68 | 112Ru | 113Rh | 114Pd | 115Ag | 116Cd | 117In | 118Sn | 119Sb | 120Te | 121I | 122Xe | 123Cs | 124Ba | 125La | Ce | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 69 | 113Ru | 114Rh | 115Pd | 116Ag | 117Cd | 118In | 119Sn
|
120Sb
|
121Te
|
122I | 123Xe | 124Cs | 125Ba | 126La | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 70 | 116Pd | 117Ag | 118Cd | 119In | 120Sn | 121Sb | 122Te | 123I | 124Xe | 125Cs | 126Ba | 127La | 59 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 71 | 117Pd | 118Ag | 119Cd | 120In | 121Sn
|
122Sb
|
123Te
|
124I | 125Xe | 126Cs | 127Ba | 128La | 129Ce | Pr | 60 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 72 | 118Pd | 119Ag | 120Cd | 121In | 122Sn | 123Sb | 124Te | 125I | 126Xe | 127Cs | 128Ba | 129La | 130Ce | Nd | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 73 | 120Ag | 121Cd | 122In | 123Sn
|
124Sb
|
125Te
|
126I | 127Xe
|
128Cs | 129Ba | 130La | 131Ce | 132Pr | 61 | 62 | 63 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 74 | 121Ag | 122Cd | 123In | 124Sn | 125Sb | 126Te | 127I | 128Xe | 129Cs | 130Ba | 131La | 132Ce | 133Pr | 134Nd | Pm | Sm | Eu | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 75 | 122Ag | 124In | 125Sn
|
126Sb
|
127Te
|
128I | 129Xe
|
130Cs | 131Ba
|
132La | 133Ce | 134Pr | 135Nd | 137Sm | 64 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 76 | 123Ag | 124Cd | 125In | 126Sn | 127Sb | 128Te | 129I | 130Xe | 131Cs | 132Ba | 133La | 134Ce | 135Pr | 136Nd | 137Pm | 138Sm | 139Eu | Gd | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 77 | 126In | 127Sn | 128Sb | 129Te
|
130I | 131Xe
|
132Cs | 133Ba
|
134La | 135Ce | 136Pr | 137Nd | 138Pm | 139Sm | 140Eu | 65 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 78 | 127In | 128Sn | 129Sb | 130Te | 131I | 132Xe | 133Cs | 134Ba | 135La | 136Ce | 137Pr | 138Nd | 139Pm | 140Sm | 141Eu | 142Gd | Tb | 66 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 79 | 128In | 129Sn | 130Sb | 131Te
|
132I | 133Xe | 134Cs
|
135Ba
|
136La | 137Ce | 138Pr | 139Nd | 140Pm | 141Sm | 142Eu | 143Gd | Dy | 67 | 68 | 69 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 80 | 129In | 130Sn | 131Sb | 132Te | 133I | 134Xe | 135Cs
|
136Ba
|
137La | 138Ce | 139Pr | 140Nd | 141Pm | 142Sm | 143Eu | 144Gd | Ho | Er | Tm | 70 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 81 | 130In | 131Sn | 132Sb | 133Te | 134I | 135Xe | 136Cs
|
137Ba
|
138La | 139Ce
|
140Pr | 141Nd | 142Pm | 143Sm | 144Eu | 145Gd | 146Tb | 147Dy | Yb | 71 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 82 | 131In | 132Sn | 133Sb | 134Te | 135I | 136Xe | 137Cs | 138Ba | 139La | 140Ce | 141Pr | 142Nd | 143Pm | 144Sm | 145Eu | 146Gd | 147Tb | 148Dy | 150Er | 151Tm | Lu | 72 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 83 | 132In | 133Sn | 134Sb | 135Te | 136I | 137Xe | 138Cs | 139Ba | 140La | 141Ce | 142Pr | 143Nd | 144Pm | 145Sm | 146Eu | 147Gd | 148Tb | 149Dy | 150Ho | 151Er | Hf | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 84 | 134Sn | 135Sb | 136Te | 137I | 138Xe | 139Cs | 140Ba | 141La | 142Ce
|
143Pr | 144Nd
|
145Pm | 146Sm | 147Eu | 148Gd | 149Tb | 150Dy | 151Ho | 152Er | 153Tm | 154Yb | 155Lu | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 85 | 136Sb | 137Te | 138I | 139Xe | 140Cs | 141Ba | 142La | 143Ce | 144Pr | 145Nd | 146Pm | 147Sm | 148Eu | 149Gd | 150Tb | 151Dy | 152Ho | 153Er | 154Tm | 155Yb | 156Lu | 157Hf | 73 | 74 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 86 | 138Te | 139I | 140Xe | 141Cs | 142Ba | 143La | 144Ce | 145Pr | 146Nd | 147Pm | 148Sm
|
149Eu | 150Gd | 151Tb | 152Dy | 153Ho | 154Er | 155Tm | 156Yb | 158Hf | Ta | W | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 87 | 140I | 141Xe | 142Cs | 143Ba | 144La | 145Ce | 146Pr | 147Nd | 148Pm
|
149Sm
|
150Eu
|
151Gd | 152Tb | 153Dy | 154Ho | 155Er | 156Tm | 157Yb | 159Hf | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 88 | 141I | 142Xe | 143Cs | 144Ba | 145La | 146Ce | 147Pr | 148Nd | 149Pm | 150Sm | 151Eu | 152Gd
|
153Tb | 154Dy | 155Ho | 156Er | 157Tm | 158Yb | 160Hf | 162W | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 89 | 142I | 143Xe | 144Cs | 145Ba | 146La | 147Ce | 148Pr | 149Nd | 150Pm | 151Sm | 152Eu
|
153Gd | 154Tb | 155Dy | 156Ho | 157Er | 158Tm | 161Hf | 163W | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 90 | 144Xe | 145Cs | 146Ba | 147La | 148Ce | 149Pr | 150Nd | 151Pm | 152Sm | 153Eu | 154Gd | 155Tb | 156Dy | 157Ho | 158Er | 159Tm | 160Yb | 161Lu | 164W | 75 | 76 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 91 | 145Xe | 146Cs | 148La | 149Ce | 150Pr | 151Nd | 152Pm | 153Sm | 154Eu
|
155Gd | 156Tb
|
157Dy | 158Ho | 159Er | 160Tm | 161Yb | 162Lu | 165W | Re | Os | 77 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 92 | 150Ce | 151Pr | 152Nd | 153Pm | 154Sm | 155Eu | 156Gd | 157Tb | 158Dy | 159Ho | 160Er | 161Tm | 162Yb | 166W | Ir | 78 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 93 | 151Ce | 154Pm | 155Sm | 156Eu | 157Gd | 158Tb
|
159Dy | 160Ho | 161Er | 162Tm | 163Yb | 164Lu | 166Ta | 169Os | Pt | 79 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 94 | 154Nd | 156Sm | 157Eu | 158Gd | 159Tb | 160Dy | 161Ho | 162Er | 163Tm | 164Yb | 165Lu | 166Hf | 167Ta | 170Os | 171Ir | Au | 80 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 95 | 157Sm | 158Eu | 159Gd | 160Tb | 161Dy | 162Ho | 163Er | 164Tm | 165Yb | 166Lu | 167Hf | 168Ta | 170Re | 171Os | 172Ir | 173Pt | Hg | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 96 | 159Eu | 160Gd | 161Tb | 162Dy | 163Ho
|
164Er | 165Tm | 166Yb | 167Lu | 168Hf | 169Ta | 170W | 172Os | 171Ir | 174Pt | 175Au | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 97 | 160Eu | 161Gd | 162Tb | 163Dy | 164Ho | 165Er | 166Tm | 167Yb | 168Lu | 169Hf | 170Ta | 171W | 172Re | 173Os | 174Ir | 175Pt | 176Au | 177Hg | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 98 | 162Gd | 163Tb | 164Dy | 165Ho | 166Er | 167Tm | 168Yb | 169Lu
|
170Hf | 171Ta | 172W | 174Os | 175Ir | 176Pt | 177Au | 178Hg | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 99 | 164Tb | 165Dy | 166Ho
|
167Er
|
168Tm | 169Yb
|
170Lu | 171Hf | 172Ta | 173W | 174Re | 175Os | 176Ir | 177Pt | 178Au | 179Hg | 81 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 100 | 166Dy | 167Ho | 168Er | 169Tm | 170Yb | 171Lu
|
172Hf | 173Ta | 174W | 175Re | 176Os | 177Ir | 178Pt | 179Au | 180Hg | Tl | 82 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 101 | 167Dy | 168Ho | 169Er | 170Tm | 171Yb | 172Lu
|
173Hf | 174Ta | 175W | 176Re | 177Os | 178Ir | 179Pt | 181Hg | Pb | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 102 | 169Ho | 170Er | 171Tm | 172Yb | 173Lu | 174Hf
|
175Ta | 176W | 177Re | 178Os | 179Ir | 180Pt | 181Au | 182Hg | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 103 | 170Ho | 171Er | 172Tm | 173Yb | 174Lu | 175Hf | 176Ta | 177W | 178Re | 179Os | 180Ir | 181Pt | 182Au | 183Hg | 184Tl | 185Pb | 83 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 104 | 172Er | 173Tm | 174Yb | 175Lu | 176Hf | 177Ta | 178W | 179Re | 180Os | 181Ir | 182Pt | 183Au | 184Hg | 185Tl | 186Pb | Bi | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 105 | 173Er | 174Tm | 175Yb
|
176Lu
|
177Hf
|
178Ta | 179W | 180Re | 181Os | 182Ir | 183Pt | 184Au | 185Hg | 186Tl | 187Pb | 84 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 106 | 175Tm | 176Yb
|
177Lu
|
178Hf
|
179Ta | 180W | 181Re | 182Os | 183Ir | 184Pt | 185Au | 186Hg | 187Tl | 188Pb | 189Bi | Po | 85 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 107 | 176Tm | 177Yb | 178Lu | 179Hf
|
180mTa
|
181W | 182Re
|
183Os | 184Ir | 185Pt | 186Au | 187Hg | 188Tl | 189Pb | 190Bi | At | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 108 | 178Yb | 179Lu | 180Hf
|
181Ta | 182W | 183Re | 184Os | 185Ir | 186Pt | 187Au | 188Hg | 189Tl | 190Pb | 191Bi | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 109 | 180Lu | 181Hf | 182Ta
|
183W
|
184Re
|
185Os | 186Ir | 187Pt | 188Au | 189Hg | 190Tl | 191Pb | 192Bi | 193Po | 194At | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 110 | 182Hf
|
183Ta | 184W | 185Re | 186Os
|
187Ir | 188Pt | 189Au | 190Hg | 191Tl | 192Pb | 193Bi | 194Po | 195At | 86 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 111 | 183Hf | 184Ta | 185W
|
186Re
|
187Os | 188Ir | 189Pt | 190Au | 191Hg | 192Tl | 193Pb | 194Bi | 195Po | 196At | Rn | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 112 | 184Hf | 185Ta | 186W | 187Re | 188Os | 189Ir | 190Pt | 191Au | 192Hg | 193Tl | 194Pb | 195Bi | 196Po | 197At | 87 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 113 | 185Hf | 186Ta | 187W | 188Re | 189Os
|
190Ir
|
191Pt | 192Au | 193Hg | 194Tl | 195Pb | 196Bi | 197Po | 198At | Fr | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 114 | 188W | 189Re | 190Os
|
191Ir
|
192Pt | 193Au | 194Hg | 195Tl | 196Pb | 197Bi | 198Po | 199At | 200Rn | 88 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 115 | 189W | 190Re | 191Os | 192Ir
|
193Pt
|
194Au | 195Hg
|
196Tl | 197Pb | 198Bi | 199Po | 200At | 201Rn | Ra | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 116 | 190W | 191Re | 192Os
|
193Ir
|
194Pt | 195Au
|
196Hg | 197Tl | 198Pb | 199Bi | 200Po | 201At | 202Rn | 203Fr | 89 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 117 | 192Re | 193Os | 194Ir | 195Pt
|
196Au
|
197Hg
|
198Tl | 199Pb | 200Bi | 201Po | 202At | 203Rn | 204Fr | Ac | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 118 | 194Os | 195Ir | 196Pt | 197Au
|
198Hg
|
199Tl | 200Pb | 201Bi | 202Po | 203At | 204Rn | 205Fr | 206Ra | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 119 | 195Os | 196Ir | 197Pt | 198Au | 199Hg | 200Tl | 201Pb | 202Bi | 203Po | 204At | 205Rn | 206Fr | 207Ra | 90 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 120 | 196Os | 197Ir | 198Pt | 199Au | 200Hg | 201Tl | 202Pb
|
203Bi | 204Po | 205At | 206Rn | 207Fr | 208Ra | 209Ac | Th | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 121 | 198Ir | 199Pt | 200Au | 201Hg | 202Tl | 203Pb
|
204Bi | 205Po | 206At | 207Rn | 208Fr | 209Ra | 210Ac | 91 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 122 | 200Pt | 201Au | 202Hg | 203Tl | 204Pb
|
205Bi | 206Po | 207At | 208Rn | 209Fr | 210Ra | 211Ac | Pa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 123 | 201Pt | 202Au | 203Hg | 204Tl | 205Pb | 206Bi | 207Po | 208At | 209Rn | 210Fr | 211Ra | 212Ac | 213Th | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 124 | 203Au | 204Hg | 205Tl | 206Pb | 207Bi | 208Po | 209At | 210Rn | 211Fr | 212Ra | 213Ac | 214Th | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 125 | 204Au | 205Hg | 206Tl | 207Pb
|
208Bi | 209Po | 210At | 211Rn | 212Fr | 213Ra | 214Ac | 215Th | 216Pa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 126 | 206Hg | 207Tl | 208Pb | 209Bi
|
210Po | 211At | 212Rn | 213Fr | 214Ra | 215Ac | 216Th | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 127 | 208Tl | 209Pb | 210Bi
|
211Po | 212At | 213Rn | 214Fr | 215Ra | 216Ac | 217Th | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 128 | 209Tl | 210Pb | 211Bi | 212Po | 213At | 214Rn | 215Fr | 216Ra | 217Ac | 218Th | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 129 | 210Tl | 211Pb | 212Bi | 213Po | 214At | 215Rn | 216Fr | 217Ra | 218Ac | 219Th | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 130 | 212Pb | 213Bi | 214Po | 215At | 216Rn | 217Fr | 218Ra | 219Ac | 220Th | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 131 | 213Pb | 214Bi | 215Po | 216At | 217Rn | 218Fr | 219Ra | 220Ac | 221Th | 222Pa | 92 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 132 | 214Pb | 215Bi | 216Po | 217At | 218Rn | 219Fr | 220Ra | 221Ac | 222Th | 223Pa | U | 93 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 133 | 217Po | 218At | 219Rn | 220Fr | 221Ra | 222Ac | 223Th | 224Pa | Np | 94 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 134 | 218Po | 219At | 220Rn | 221Fr | 222Ra | 223Ac | 224Th | 225Pa | 226U | Pu | 95 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 135 | 221Rn | 222Fr | 223Ra | 224Ac | 225Th | 226Pa | 227U | 228Np | Am | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 136 | 222Rn | 223Fr | 224Ra | 225Ac | 226Th | 227Pa | 228U | 229Np | 96 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 137 | 223Rn | 224Fr | 225Ra | 226Ac | 227Th | 228Pa | 229U | 230Np | 232Am | Cm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 138 | 224Rn | 225Fr | 226Ra | 227Ac | 228Th | 229Pa | 230U | 231Np | 232Pu | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 139 | 225Rn | 226Fr | 227Ra | 228Ac | 229Th | 230Pa | 231U | 232Np | 233Pu | 234Am | 97 | 98 | 99 | 100 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 140 | 226Rn | 227Fr | 228Ra | 229Ac | 230Th | 231Pa | 232U | 233Np | 234Pu | 235Am | 236Cm | Bk | Cf | Es | Fm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 141 | 228Fr | 229Ra | 230Ac | 231Th | 232Pa | 233U | 234Np | 235Pu | 236Am | 237Cm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 142 | 229Fr | 230Ra | 231Ac | 232Th | 233Pa | 234U | 235Np | 236Pu | 237Am | 238Cm | 239Bk | 240Cf | 241Es | 242Fm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 143 | 232Ac | 233Th | 234Pa | 235U
|
236Np
|
237Pu | 238Am | 239Cm | 240Bk | 241Cf | 242Es | 243Fm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 144 | 234Th | 235Pa | 236U | 237Np | 238Pu | 239Am | 240Cm | 241Bk | 242Cf | 243Es | 244Fm | 101 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 145 | 235Th | 236Pa | 237U | 238Np | 239Pu | 240Am | 241Cm | 242Bk | 243Cf | 244Es | 245Fm | Md | 102 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 146 | 236Th | 237Pa | 238U | 239Np | 240Pu | 241Am | 242Cm | 243Bk | 244Cf | 245Es | 246Fm | No | 103 | 104 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 147 | 238Pa | 239U | 240Np | 241Pu | 242Am
|
243Cm | 244Bk | 245Cf | 246Es | 247Fm | 248Md | Lr | Rf | 105 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 148 | 240U | 241Np | 242Pu | 243Am | 244Cm | 245Bk | 246Cf | 247Es | 248Fm | 249Md | 250No | Db | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 149 | 243Pu | 244Am | 245Cm | 246Bk | 247Cf | 248Es | 249Fm | 250Md | 251No | 252Lr | 253Rf | 106 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 150 | 244Pu | 245Am | 246Cm | 247Bk | 248Cf | 249Es | 250Fm | 251Md | 252No | 253Lr | 254Rf | 255Db | Sg | 107 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 151 | 245Pu | 246Am | 247Cm | 248Bk
|
249Cf | 250Es | 251Fm | 252Md | 253No | 254Lr | 255Rf | 256Db | Bh | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 152 | 246Pu | 247Am | 248Cm | 249Bk | 250Cf | 251Es | 252Fm | 253Md | 254No | 255Lr | 256Rf | 257Db | 258Sg | 108 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 153 | 249Cm | 250Bk | 251Cf | 252Es | 253Fm | 254Md | 255No | 256Lr | 257Rf | 258Db | 259Sg | 260Bh | Hs | 109 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 154 | 250Cm | 251Bk | 252Cf | 253Es | 254Fm | 255Md | 256No | 257Lr | 258Rf | 259Db | 260Sg | 261Bh | Mt | 110 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 155 | 251Cm | 252Bk | 253Cf | 254Es
|
255Fm | 256Md | 257No | 258Lr | 259Rf | 260Db | 261Sg | 262Bh | 263Hs | Ds | 111 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 156 | 253Bk | 254Cf | 255Es | 256Fm | 257Md | 258No | 259Lr | 260Rf | 261Db | 262Sg | 263Bh | 264Hs | 265Mt | Rg | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 157 | 254Bk | 255Cf | 256Es | 257Fm | 258Md | 259No | 260Lr | 261Rf | 262Db | 263Sg | 264Bh | 265Hs | 266Mt | 267Ds | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 158 | 256Cf | 257Es | 258Fm | 259Md | 260No | 261Lr | 262Rf | 263Db | 264Sg | 265Bh | 266Hs | 267Mt | 268Ds | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 159 | 259Fm | 260Md | 261No | 262Lr | 263Rf | 264Db | 265Sg | 266Bh | 267Hs | 268Mt | 269Ds | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 160 | 262No | 263Lr | 264Rf | 265Db | 266Sg | 267Bh | 268Hs | 269Mt | 270Ds | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 161 | 269Hs | 270Mt | 271Ds | 272Rg | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 162 | 271Mt | 272Ds | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Notes et références[modifier | modifier le code]
Notes[modifier | modifier le code]
- On indique le numéro atomique quand il aide à la compréhension, et notamment dans les réactions nucléaires et les réactions de désintégration pour comprendre le sort de chaque type de particule (proton ou neutron).
- Quand on utilise les symboles D et T, le symbole H désigne le protium au lieu de l'élément chimique. On écrit alors H2O, HDO et D2O les formules chimiques de l'eau légère, de l'eau semi-lourde et de l'eau lourde.
- Compte tenu du rapport des masses, pour ce qui concerne les grandeurs par unité de masse.
- On sait depuis 2003 que le bismuth 209 est radioactif, mais sa demi-vie est tellement grande (19 × 1018 années donc plus d'un milliard de fois l'âge de l'univers !) que pour toute considération pratique on peut le considérer comme stable.
Références[modifier | modifier le code]
- IUPAC, « isotopes » (consulté le )
- « Isotope », dictionnaire Larousse (consulté le )
- Milton H. Wahl and Harold C. Urey (1935). J. Chem. Phys. 3, 411. The Vapor Pressures of the Isotopic Forms of Water. « http://jcp.aip.org/resource/1/jcpsa6/v3/i7/p411_s1 »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?).
- Živilė Žigaité, Le rapport 18O/16O dans les apatites des vertébrés du Paléozoïque : possibilités et limites des reconstitutions paléoclimatiques ; Palaeoclimate and Stable Isotope Geochemistry
- S. C. Maisant, A. F. Villa, J. Poupon, J. Langrand et R. Garnier, « L’analyse isotopique du plomb: un outil utile en santé au travail quand les sources d’exposition au plomb sont multiples », Archives des Maladies Professionnelles et de l'Environnement, vol. 77, no 3, , p. 485 (résumé).
- (en) P. Álvarez-Iglesias, B. Rubio et J. Millos, « Isotopic identification of natural vs. anthropogenic lead sources in marine sediments from the inner Ría de Vigo (NW Spain) », Science of The Total Environment, vol. 437, , p. 22-35.
- N Hette-Tronquart, J Belliard, Caractérisation des réseaux trophiques en cours d’eau, 2016 ([1])
- E. Piasentier, R. Valusso, F. Camin, G. Versini, Stable isotope ratio analysis for authentication of lamb meat ; Meat Science, Volume 64, Issue 3, July 2003, Pages 239–247 ([Résumé])
- M.A Brescia, M Monfreda, A Buccolieri, C Carrino, Characterisation of the geographical origin of buffalo milk and mozzarella cheese by means of analytical and spectroscopic determinations ; Food Chemistry Volume 89, Issue 1, January 2005, Pages 139–147 (résumé)
- D. Sacco, M.A. Brescia, A. Buccolieri, A. Caputi Jambrenghi, Geographical origin and breed discrimination of Apulian lamb meat samples by means of analytical and spectroscopic determinations ; Meat Science Volume 71, Issue 3, November 2005, Pages 542–548 (Résumé)
- Estelle Herrscher, « Détection isotopique des modalités d’allaitement et de sevrage à partir des ossements archéologiques », Cahiers de Nutrition et de Diététique, vol. 48, no 2, , p. 75–85 (DOI 10.1016/j.cnd.2012.12.004, lire en ligne, consulté le )
- Estelle Herrscher, « Alimentation d’une population historique: Analyse des données isotopiques de la nécropole Saint-Laurent de Grenoble (XIIIe – Xe siècle, France) », Bulletins et mémoires de la société d'anthropologie de Paris, vol. 15, nos 3-4, , p. 149–269 (ISSN 0037-8984 et 1777-5469, DOI 10.4000/bmsap.550, lire en ligne, consulté le )
- Estelle Herrscher, Hervé Bocherens, Frédérique Valentin et Renée Colardelle, « Comportements alimentaires au Moyen Âge à Grenoble : application de la biogéochimie isotopique à la nécropole Saint-Laurent (XIIIe – XVe siècles, Isère, France) », Comptes Rendus de l'Académie des Sciences - Series III - Sciences de la Vie, vol. 324, no 5, , p. 479–487 (DOI 10.1016/S0764-4469(01)01316-6, lire en ligne, consulté le )
- François Djindjian, Manuel d'archéologie, Armand Colin, (ISBN 978-2-200-26676-9, DOI 10.3917/arco.djind.2011.01, lire en ligne)
- (en) Jordan A. Hachtel, « Isotopes tracked on a sub-nanometre scale using electron spectroscopy », Nature, vol. 603, no 7899, , p. 36–37 (DOI 10.1038/d41586-022-00545-1, lire en ligne, consulté le ).
Voir aussi[modifier | modifier le code]
Articles connexes[modifier | modifier le code]
- Isobare (chimie)
- Isotone
- Classification périodique des éléments
- Période radioactive
- Radioactivité
- Noyau exotique
- Table des isotopes
- Isotope stable
- Hydrologie isotopique
- Radioisotope synthétique
- Chronologie isotopique
- Méthodes scientifiques de l'archéologie
- Paléontologie
- Paléoclimatologie
- Rapport isotopique
Liens externes[modifier | modifier le code]
- (en) The Isotopes Project Home Page (Compilation et diffusion de données sur les isotopes)
| 1 | H | He | ||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
