« Dioxygène » : différence entre les versions
O2 devient O3 Balises : Révoqué Suppression de références Éditeur visuel |
mAucun résumé des modifications |
||
| (37 versions intermédiaires par 26 utilisateurs non affichées) | |||
| Ligne 1 : | Ligne 1 : | ||
{{redirect|O2|homonymie=O2 (homonymie)}} |
{{redirect|O2|homonymie=O2 (homonymie)}} |
||
{{redirect homophones|O2|Audeux}} |
|||
{{2autres|le corps simple {{O2}}|l'élément chimique|Oxygène|les autres significations du mot Oxygène|Oxygène (homonymie)}} |
{{2autres|le corps simple {{O2}}|l'élément chimique|Oxygène|les autres significations du mot Oxygène|Oxygène (homonymie)}} |
||
{{Infobox Chimie |
{{Infobox Chimie |
||
| Ligne 17 : | Ligne 16 : | ||
| ATC = {{ATC|V03AN01}} |
| ATC = {{ATC|V03AN01}} |
||
| DrugBank = |
| DrugBank = |
||
| PubChem = 977 |
| PubChem = {{CID|977}} |
||
| chEBI = |
| chEBI = |
||
| NrE = {{NrE|E948}} |
| NrE = {{NrE|E948}} |
||
| FEMA = {{FEMA|}} |
| FEMA = {{FEMA|}} |
||
| SMILES = O=O |
| SMILES = O=O |
||
| InChI = |
| InChI = 1S/O2/c1-2 |
||
| InChIKey = |
| InChIKey = MYMOFIZGZYHOMD-UHFFFAOYSA-N |
||
| StdInChI = |
| StdInChI = |
||
| StdInChIKey = |
| StdInChIKey = |
||
| Ligne 53 : | Ligne 52 : | ||
| pointEclair = |
| pointEclair = |
||
| limitesExplosivite = |
| limitesExplosivite = |
||
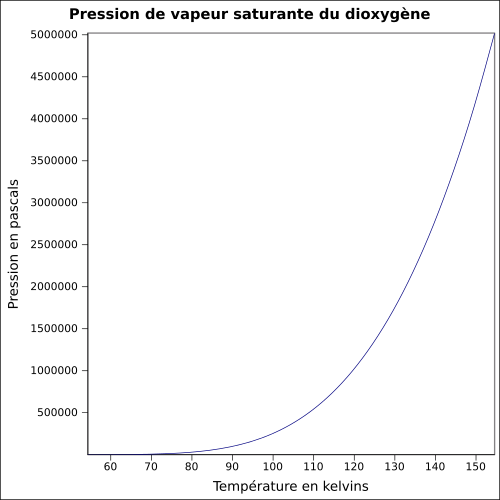
| pressionVapeur = à {{tmp|-118|°C}} : {{unité |
| pressionVapeur = à {{tmp|-118|°C}} : {{unité|5080 kPa}}<ref name="ICSC"/> |
||
{{Infobox Chimie/Pression vapeur|A=51.245|B=-1200.2|C=-6.4361|D=2.8405E-2|E=1|Tunite=K|Punite=Pa|Tmin=54.36|Pmin=1.4754E2|Tmax=154.58|Pmax=5.0206E6|arrondi=2|graphique=Pvs dioxygène.svg|tailleGraphique=500px|ref=<ref name="Perry’s">{{Ouvrage | langue=en | prénom1=Robert H. | nom1=Perry | prénom2=Donald W. | nom2=Green | titre=Perry's Chemical Engineers' Handbook | éditeur=McGraw-Hill | lieu=États-Unis | année=1997 | numéro d'édition=7 | pages totales=2400 | passage=2-50 | isbn=0-07-049841-5 | consulté le=23 juin 2010}}.</ref>}} |
{{Infobox Chimie/Pression vapeur|A=51.245|B=-1200.2|C=-6.4361|D=2.8405E-2|E=1|Tunite=K|Punite=Pa|Tmin=54.36|Pmin=1.4754E2|Tmax=154.58|Pmax=5.0206E6|arrondi=2|graphique=Pvs dioxygène.svg|tailleGraphique=500px|ref=<ref name="Perry’s">{{Ouvrage | langue=en | prénom1=Robert H. | nom1=Perry | prénom2=Donald W. | nom2=Green | titre=Perry's Chemical Engineers' Handbook | éditeur=[[McGraw-Hill Education|McGraw-Hill]] | lieu=États-Unis | année=1997 | numéro d'édition=7 | pages totales=2400 | passage=2-50 | isbn=0-07-049841-5 | consulté le=23 juin 2010}}.</ref>}} |
||
| viscosite = |
| viscosite = |
||
| pointCritique = {{tmp|-118.67|°C}} <br /> {{unité |
| pointCritique = {{tmp|-118.67|°C}} <br /> {{unité|50.422 bar}} <br /> {{unité|0.6361|kg||l|-1}}<ref name="GESTIS"/> |
||
| pointTriple = {{tmp|-218.7916|°C}}<ref>''Procès-verbaux du Comité international des poids et mesures'', {{78e|session}}, 1989, [http://www.bipm.org/utils/common/pdf/its-90/EIT-90.pdf {{p.}}T1-T21] (et {{p.}}T23-T42, version anglaise).</ref><br /> {{unité |
| pointTriple = {{tmp|-218.7916|°C}}<ref>''Procès-verbaux du Comité international des poids et mesures'', {{78e|session}}, 1989, [http://www.bipm.org/utils/common/pdf/its-90/EIT-90.pdf {{p.}}T1-T21] (et {{p.}}T23-T42, version anglaise).</ref><br /> {{unité|0.00149 bar}}<ref name="GESTIS"/> |
||
| conductivitéThermique = |
| conductivitéThermique = |
||
| conductivitéÉlectrique = |
| conductivitéÉlectrique = |
||
| vitesseSon = {{ |
| vitesseSon = {{unité|330|m||s|-1}} ({{tmp|27|°C}}, {{unité|1 atm|}})<ref>{{HBChemPhys|91|14-40}}.</ref> |
||
<!-- Thermochimie --> |
<!-- Thermochimie --> |
||
| emsGaz = |
| emsGaz = |
||
| Ligne 69 : | Ligne 68 : | ||
| esfSolide = |
| esfSolide = |
||
| enthFus = {{nb|213 kJ/kg}} |
| enthFus = {{nb|213 kJ/kg}} |
||
| enthVap = {{ |
| enthVap = {{unité|6.82 kJ/mol}} ({{Unité|1 atm}}, {{tmp|-182.95|°C}})<ref>{{HBChemPhys|90}}.</ref> |
||
| capaciteTherm = {{Infobox Chimie/Capacité thermique|etat=liquide|masseMol=31.999|A=175430|B=-6152.3|C=113.92|D=-0.92382|E=2.7963E-3|Tmin=54.36|Cp(Tmin)=53650|Tmax=142|Cp(Tmax)=90660|arrondi=0|graphique=Capacité thermique dioxygène.svg|tailleGraphique=500px|ref=<ref name="Perry’s"/>}} |
| capaciteTherm = {{Infobox Chimie/Capacité thermique|etat=liquide|masseMol=31.999|A=175430|B=-6152.3|C=113.92|D=-0.92382|E=2.7963E-3|Tmin=54.36|Cp(Tmin)=53650|Tmax=142|Cp(Tmax)=90660|arrondi=0|graphique=Capacité thermique dioxygène.svg|tailleGraphique=500px|ref=<ref name="Perry’s"/>}} |
||
| PCS = |
| PCS = |
||
| Ligne 118 : | Ligne 117 : | ||
| SIMDUTref = <ref>{{Reptox|CAS=7782-44-7|Date=25 avril 2009}}.</ref> |
| SIMDUTref = <ref>{{Reptox|CAS=7782-44-7|Date=25 avril 2009}}.</ref> |
||
| SIMDUT = {{SIMDUT/2| A = Gaz comprimé<br />température critique = {{tmp|-118.57|°C}}| C = Matière comburante<br />cause ou favorise la combustion d'une autre matière<br /><br />Divulgation à 1,0 % selon les critères de classification}} |
| SIMDUT = {{SIMDUT/2| A = Gaz comprimé<br />température critique = {{tmp|-118.57|°C}}| C = Matière comburante<br />cause ou favorise la combustion d'une autre matière<br /><br />Divulgation à 1,0 % selon les critères de classification}} |
||
| SGHref = <ref |
| SGHref = <ref>Numéro index {{IndexCE|008-001-00-8}} dans le tableau 3.1 de l'annexe VI du [http://eur-lex.europa.eu/LexUriServ/LexUriServ.do?uri=OJ:L:2008:353:0001:1355:FR:PDF règlement CE {{N°}}1272/2008] (16 décembre 2008).</ref> |
||
| SGH = {{SGH|SGH03|SGH04|Dgr|H270}} |
| SGH = {{SGH|SGH03|SGH04|Dgr|H270}} |
||
| CIRC = |
| CIRC = |
||
| Ligne 162 : | Ligne 161 : | ||
}} |
}} |
||
Le '''dioxygène''', communément nommé '''oxygène''', est une [[substance chimique|substance]] constituée de [[molécule]]s |
Le '''dioxygène''', communément nommé '''oxygène''', est une [[substance chimique|substance]] constituée de [[molécule]]s {{O2}} (constituées chacune de deux [[atome]]s d'[[oxygène]]). [[Gaz]]eux dans les [[conditions normales de température et de pression]], incolore, inodore et insipide, il participe à des [[Réaction d'oxydoréduction|réactions d'oxydoréduction]], essentiellement la [[combustion]], la [[corrosion]] et la [[respiration]]. Le dioxygène est l'une des [[allotropie de l'oxygène|formes allotropiques de l'oxygène]]. |
||
L'appellation « |
L'appellation « oxygène » sans autre précision est ambiguë parce que ce terme peut désigner l'élément oxygène (O) ou le gaz oxygène ({{O2}}){{note|groupe=alpha|La même ambiguïté concerne de nombreux autres [[Élément chimique|éléments]] ([[hydrogène]], [[azote]], [[chlore]]{{etc.}}).}}. |
||
Découvert indépendamment en 1772 par le [[Suède|Suédois]] [[Carl Wilhelm Scheele]] à [[Uppsala]], et en 1774 par le [[Royaume-Uni|Britannique]] [[Joseph Priestley]] dans le [[Wiltshire]], l'[[oxygène]] a été nommé ainsi en 1777 par le [[France|Français]] [[Antoine Lavoisier]] |
Découvert indépendamment en 1772 par le [[Suède|Suédois]] [[Carl Wilhelm Scheele]] à [[Uppsala]], et en 1774 par le [[Royaume-Uni|Britannique]] [[Joseph Priestley]] dans le [[Wiltshire]], l'[[oxygène]] a été nommé ainsi en 1777 par le [[France|Français]] [[Antoine Lavoisier]] à [[Paris]] à partir du [[grec ancien]] {{grec ancien|ὀξύς}} / ''{{Lang|grc-Latn|oxús}}'' (« aigu », c'est-à-dire ici « acide »), et {{grec ancien|γενής}} / ''{{Lang|grc-Latn|genếs}}'' (« générateur »), car Lavoisier pensait à tort {{Incise|oxydation et acidification étant reliées}} que<ref>[[Antoine Lavoisier|Lavoisier A.]] (1789), ''[[Traité élémentaire de chimie]]'', 1864, {{p.|48}}.</ref> : |
||
{{citation bloc|Nous avons donné à la base de la portion respirable de l'air le nom d'oxygène, en le dérivant de deux mots grecs {{grec ancien|ὀξύς}}, ''acide'' et {{grec ancien|γείνομαι}}, ''j'engendre'', parce qu'en effet une des propriétés les plus générales de cette base [Lavoisier parle de l'oxygène] est de former des acides en se combinant avec la plupart des substances. Nous appellerons donc gaz oxygène la réunion de cette base avec le calorique.}} |
{{citation bloc|Nous avons donné à la base de la portion respirable de l'air le nom d'oxygène, en le dérivant de deux mots grecs {{grec ancien|ὀξύς}}, ''acide'' et {{grec ancien|γείνομαι}}, ''j'engendre'', parce qu'en effet une des propriétés les plus générales de cette base [Lavoisier parle de l'oxygène] est de former des acides en se combinant avec la plupart des substances. Nous appellerons donc gaz oxygène la réunion de cette base avec le [[calorique]].}} |
||
Constituant 20,95 % en volume de l'[[atmosphère terrestre]] (23,2 % en masse), le dioxygène est un gaz indispensable à la plupart des formes de vie actuelles, auxquelles il fournit le [[comburant]] nécessaire au fonctionnement des cellules ([[respiration cellulaire]]). Dans l'environnement aquatique, le dioxygène dissous est également nécessaire à la vie de très nombreuses espèces<ref>{{en}} University of Wisconsin. (2006), ''{{Lang|en|texte=Dissolved oxygen:aquatic life depends on it}}'', {{Lang|en|texte=Water Action Volunteers-Volunteer Stream Monitoring Factsheet Series}}, [http://watermonitoring.uwex.edu/pdf/level1/FactSeries-DissolvedOxygen.pdf lire en ligne] (consulté le 25 février 2010).</ref>. Seules les [[Archaea|archées]] et une fraction minoritaire des [[bactérie]]s (dites [[anaérobie]]s), peuvent se passer du dioxygène. Ce sont les bactéries anaérobies productrices de dioxygène qui ont [[Réaction d'oxydoréduction|oxydé]] l'atmosphère primitive initialement [[réducteur (chimie)|réductrice]], puis l'ont enrichie en dioxygène : ce dernier est présent en abondance dans l'air depuis la [[Grande Oxydation]], il y a environ {{nobr|2,4 milliards}} d'années. |
Constituant 20,95 % en volume de l'[[atmosphère terrestre]] (23,2 % en masse), le dioxygène est un gaz indispensable à la plupart des formes de vie actuelles, auxquelles il fournit le [[comburant]] nécessaire au fonctionnement des cellules ([[respiration cellulaire]]). Dans l'environnement aquatique, le dioxygène dissous est également nécessaire à la vie de très nombreuses espèces (comme les poissons)<ref>{{en}} University of Wisconsin. (2006), ''{{Lang|en|texte=Dissolved oxygen:aquatic life depends on it}}'', {{Lang|en|texte=Water Action Volunteers-Volunteer Stream Monitoring Factsheet Series}}, [http://watermonitoring.uwex.edu/pdf/level1/FactSeries-DissolvedOxygen.pdf lire en ligne] (consulté le 25 février 2010).</ref>. Seules les [[Archaea|archées]] et une fraction minoritaire des [[bactérie]]s (dites [[anaérobie]]s), peuvent se passer du dioxygène. Ce sont les bactéries [[Anaérobie|anaérobies]] productrices de dioxygène qui ont [[Réaction d'oxydoréduction|oxydé]] l'atmosphère primitive initialement [[réducteur (chimie)|réductrice]], puis l'ont enrichie en dioxygène : ce dernier est présent en abondance dans l'air depuis la [[Grande Oxydation]], il y a environ {{nobr|2,4 milliards}} d'années. |
||
== Origine et évolution du dioxygène de l'atmosphère terrestre == |
== Origine et évolution du dioxygène de l'atmosphère terrestre == |
||
De nombreuses hypothèses ont été avancées pour expliquer la présence de dioxygène dans l'atmosphère : |
De nombreuses hypothèses ont été avancées pour expliquer la présence de dioxygène dans l'atmosphère : |
||
* la plus communément retenue est qu'il s'agit d'un gaz produit lors du fonctionnement des [[ |
* la plus communément retenue est qu'il s'agit d'un gaz produit lors du fonctionnement des [[Cyanobacteria|cyanobactéries]], et plus généralement des végétaux [[chlorophylle|chlorophylliens]], extrayant le [[carbone]] du [[dioxyde de carbone]] (sous forme de composés organiques) et rejetant l'oxygène (sous forme de dioxygène) par le mécanisme de la [[photosynthèse]] ; |
||
* une seconde invoque la décomposition, dans la haute [[atmosphère terrestre|atmosphère]], de [[molécule d'eau|molécules d'eau]] en dioxygène et [[dihydrogène]], sous l'effet des rayonnements solaire et cosmique. Le dihydrogène s'échappant définitivement dans l'espace (au rythme, actuellement, d'environ {{unité|3 |
* une seconde invoque la décomposition, dans la haute [[atmosphère terrestre|atmosphère]], de [[molécule d'eau|molécules d'eau]] en dioxygène et [[dihydrogène]], sous l'effet des rayonnements solaire et cosmique. Le dihydrogène s'échappant définitivement dans l'espace (au rythme, actuellement, d'environ {{unité|3 {{abrd|kg/s|kilogrammes par seconde}}}}), le dioxygène s'accumule dans l'atmosphère. |
||
Les deux phénomènes existants, la réalité peut être une combinaison des deux processus. |
Les deux phénomènes existants, la réalité peut être une combinaison des deux processus. |
||
| Ligne 180 : | Ligne 179 : | ||
=== Cyanobactéries === |
=== Cyanobactéries === |
||
{{section à sourcer|date=mai 2017}} |
{{section à sourcer|date=mai 2017}} |
||
Il y a |
Il y a quatre milliards d'années, la [[Terre]] est presque totalement recouverte d'eau et son atmosphère est composée de [[méthane]], d'ammoniac et de dioxyde de carbone<ref>{{Lien web|titre=Il était une fois la vie : la chimie dans l’océan terrestre il y a 4 milliards d’années |url=https://www.encyclopedie-environnement.org/vivant/etait-vie-chimie-locean-terrestre-y-a-4-milliards-dannees/ |site=Encyclopédie de l'environnement |date=2017-05-11 |consulté le=2022-02-13}}.</ref>. Les premières [[bactérie]]s présentes dans l'océan utilisent exclusivement la [[fermentation]] comme source d'énergie. Peu à peu en évoluant, elles deviennent capables d'utiliser la lumière solaire comme source d'[[Énergie solaire|énergie]], le [[dioxyde de carbone|{{CO2}}]] comme source de carbone et l'{{H2O}} ou l'{{H2S}} comme source d'hydrogène. C'est l'apparition de la photosynthèse. Ces organismes [[Autotrophie|autotrophes]], c'est-à-dire capables de créer leurs propres nutriments, vont se développer, se propager et muter en [[cyanobactéries]] il y a {{nobr|3,2 milliards}} d'années. |
||
Ces [[ |
Ces [[Cyanobacteriota|cyanobactéries]] utilisent l'eau comme source d'hydrogène et rejettent du dioxygène dans leur milieu, un poison mortel pour toutes les autres bactéries [[anaérobie]]s. Cette compétition autour du dioxygène entre les bactéries est un tournant décisif dans l'évolution de la vie. La prolifération des cyanobactéries modifie totalement la composition de l'atmosphère et des océans en les enrichissant en dioxygène. En parallèle, des bactéries évoluent pour pouvoir utiliser ce dioxygène dans leur métabolisme à la place de la fermentation, ce sont les premiers organismes à réaliser la [[respiration cellulaire]]. En effet, les rendements énergétiques de la respiration sont bien supérieurs à la fermentation, donnant à ces êtres vivants un avantage évolutif des plus importants. |
||
Il y a environ |
Il y a environ deux milliards d'années, une cellule [[Eukaryota|eucaryote]] primitive (anaérobie) avale une bactérie capable de réaliser la respiration. Cette bactérie internalisée par [[phagocytose]] deviendra la [[mitochondrie]], actuellement présente dans toutes les cellules aérobies. À noter que les mitochondries ont leur propre [[Acide désoxyribonucléique|ADN]], possédant toutes les caractéristiques d'un ADN dit bactérien ([[ADN circulaire]]). |
||
=== Évolution du taux de dioxygène dans l'atmosphère terrestre === |
=== Évolution du taux de dioxygène dans l'atmosphère terrestre === |
||
| Ligne 193 : | Ligne 192 : | ||
|- |
|- |
||
! Étape |
! Étape |
||
! Période ({{abrd|Ga|gigaannum = milliards d'années}}) |
! Période ({{abrd|Ga|gigaannum {{=}} milliards d'années}}) |
||
! Caractéristiques |
! Caractéristiques |
||
|- |
|- |
||
| 1<ref>[[Archéen]].</ref> || 3,85–2,45 || Pas de production d'{{O2}} jusqu'à 3,5 Ga puis production par des [[procaryote]]s autotrophes, l'{{O2}} étant consommé par les « puits à oxygène » sous-marins, formant notamment les [[Formation ferrifère rubanée|formations ferrifères rubanées]]. |
| 1<ref>[[Archéen]].</ref> || 3,85–2,45 || Pas de production d'{{O2}} jusqu'à {{unité|3,5 Ga}} puis production par des [[procaryote]]s autotrophes, l'{{O2}} étant consommé par les « puits à oxygène » sous-marins, formant notamment les [[Formation ferrifère rubanée|formations ferrifères rubanées]]. |
||
|- |
|- |
||
| 2<ref>Début du [[Protérozoïque]].</ref> || 2,45–1,85 || La séquestration de l'{{O2}} dans ces puits sous-marins commence à diminuer, ce qui initie la [[catastrophe de l'oxygène]]. L'{{O2}} qui s'échappe dans l'atmosphère est toxique pour les procaryotes anaérobies et est un gaz corrosif qui, en attaquant les roches, est à l'origine de {{formatnum:2500}} des {{ |
| 2<ref>Début du [[Protérozoïque]].</ref> || 2,45–1,85 || La séquestration de l'{{O2}} dans ces puits sous-marins commence à diminuer, ce qui initie la [[catastrophe de l'oxygène]]. L'{{O2}} qui s'échappe dans l'atmosphère est toxique pour les procaryotes anaérobies et est un gaz corrosif qui, en attaquant les roches, est à l'origine de {{formatnum:2500}} des {{nobr|4 500 minéraux}} actuellement présents sur terre. |
||
|- |
|- |
||
| 3<ref>Majeure partie du [[Protérozoïque]].</ref> || 1,85–0,85 || Les océans dégagent de l'{{O2}} mais il est absorbé par les {{lien|fr=lits rouges|lang=en|trad=Red beds}} et la constitution de la [[couche d'ozone]]. |
| 3<ref>Majeure partie du [[Protérozoïque]].</ref> || 1,85–0,85 || Les océans dégagent de l'{{O2}} mais il est absorbé par les {{lien|fr=lits rouges|lang=en|trad=Red beds}} et la constitution de la [[couche d'ozone]]. |
||
| Ligne 204 : | Ligne 203 : | ||
| 4<ref>Fin du [[Protérozoïque]].</ref> et 5<ref>[[Phanérozoïque]].</ref> || 0,85–0,54<br />0,54–présent || Les puits d'{{O2}} sont saturés et l'{{O2}} s'accumule dans l'atmosphère. |
| 4<ref>Fin du [[Protérozoïque]].</ref> et 5<ref>[[Phanérozoïque]].</ref> || 0,85–0,54<br />0,54–présent || Les puits d'{{O2}} sont saturés et l'{{O2}} s'accumule dans l'atmosphère. |
||
|}]] |
|}]] |
||
Le dioxygène était quasiment inexistant dans l'[[atmosphère terrestre]] avant que les [[Archaea|archées]] et les [[bacteria|bactéries]] ne se développent, probablement il y a environ {{ |
Le dioxygène était quasiment inexistant dans l'[[atmosphère terrestre]] avant que les [[Archaea|archées]] et les [[bacteria|bactéries]] ne se développent, probablement il y a environ {{nobr|3,5 milliards}} d'années. Le dioxygène à l'état libre apparaît pour la première fois en quantité significative durant le [[paléoprotérozoïque]] (il y a entre 2,5 et {{nobr|1,6 milliard}} d'années environ). Pendant le premier milliard d'années, tout le dioxygène produit par ces organismes se combine à du [[fer]] dissous dans les océans pour former des [[Formation ferrifère rubanée|formations ferrifères rubanées]]. Quand ces puits d'oxygène sont saturés, le dioxygène libre commence à être relargué des océans, il y a {{nobr|2,7 milliards}} d'années. Sa concentration atteint 10 % de son niveau actuel il y a environ {{nobr|1,7 milliard}} d'années<ref>{{Ouvrage |langue=en |prénom1=Neil A. |nom1=Campbell |prénom2=Jane B. |nom2=Reece |titre=Biology |numéro d'édition=7 |éditeur=[[Pearson (maison d'édition)|Pearson]] – Benjamin Cummings |lieu=San Francisco |année=2005 |pages totales=1231 |passage=522-23 |isbn=0-8053-7171-0}}.</ref>. |
||
La présence d'une grande quantité de dioxygène dissous dans les océans et dans l'atmosphère peut avoir conduit à l'extinction les organismes [[anaérobie]]s qui vivent alors, au cours de la crise écologique nommée la [[Grande Oxydation]] il y a environ {{ |
La présence d'une grande quantité de dioxygène dissous dans les océans et dans l'atmosphère peut avoir conduit à l'extinction les organismes [[anaérobie]]s qui vivent alors, au cours de la crise écologique nommée la [[Grande Oxydation]] il y a environ {{nobr|2,4 milliards}} d'années. Toutefois, la respiration cellulaire utilisant le dioxygène permet aux organismes [[aérobie]]s de produire beaucoup plus d'[[adénosine triphosphate]] (ATP) que les organismes anaérobies, les aidant ainsi à dominer la [[biosphère]] terrestre<ref>{{Ouvrage |langue=en |prénom1=Scott |nom1=Freeman |titre=Biological Science, 2nd |éditeur=[[Pearson (maison d'édition)|Pearson]] – [[Prentice Hall]] |lieu=Upper Saddle River, NJ |année=2005 |passage=214, 586 |isbn=0-13-140941-7}}.</ref>. |
||
Depuis le début du [[Cambrien]] il y a |
Depuis le début du [[Cambrien]] il y a 540 millions d'années, la concentration d'oxygène dans l'atmosphère a évolué, représentant au fil du temps entre 15 % et 30 % de son volume<ref name="geologic">{{Article |langue=en |prénom1=Robert A. |nom1=Berner |titre=Atmospheric oxygen over Phanerozoic time |périodique=Proceedings of the National Academy of Sciences of the USA |année=1999 |volume=96 |numéro=20 |pages=10955–57 |pmid=10500106 |doi=10.1073/pnas.96.20.10955 |url texte=http://www.pnas.org/cgi/content/full/96/20/10955}}.</ref>. Vers la fin du [[Carbonifère]] il y a environ {{nobr|300 millions}} d'années, le taux de dioxygène atmosphérique atteint un maximum : il représente alors 35 % du volume de l'atmosphère<ref name="geologic"/> ce qui pourrait avoir contribué à la grande taille des [[insecte]]s et des [[amphibien]]s de l'époque<ref>{{citer doi|10.1111/j.1472-4669.2009.00188.x}}.</ref>. Cette culmination de sa proportion dans l'atmosphère terrestre à cette époque est due à l'expansion massive des [[forêt]]s de [[fougère]]s géantes sur la [[Pangée]], et à l'enfouissement progressif des produits organiques qui sont devenus les gisements de [[Houille|charbon]]<ref name="geologic"/>. Les activités humaines, y compris la combustion de sept milliards de tonnes de [[combustible fossile|combustibles fossiles]] chaque année ont un très faible impact sur la quantité d'oxygène libre dans l'atmosphère<ref name="Livre 1"/>. Au rythme actuel de la photosynthèse, il faudrait environ deux mille ans pour produire la totalité du dioxygène présent aujourd'hui dans l'atmosphère<ref>{{Article |langue=en |prénom1=Malcolm |nom1=Dole |titre=The Natural History of Oxygen |périodique=The Journal of General Physiology |année=1965 |volume=49 |numéro=1 |pages=5-27 |doi=10.1085/jgp.49.1.5 |pmid=5859927 |url texte=http://www.jgp.org/cgi/reprint/49/1/5.pdf |consulté le=29 juin 2013}}.</ref>. |
||
== Rôles biologiques == |
== Rôles biologiques == |
||
=== Photosynthèse === |
=== Photosynthèse === |
||
Dans la nature, le dioxygène à l'état libre est produit par [[photolyse]] de l'[[eau]] grâce à la [[photosynthèse]]. D'après certaines estimations, les [[algue verte|algues vertes]] et les [[cyanobacteria|cyanobactéries]] présentes en [[Océan|milieu marin]] fournissent environ 70 % du dioxygène à l'état libre produit sur Terre, le reste étant produit par les [[plante]]s terrestres<ref>{{Chapitre |langue=en |prénom1=William |nom1=Fenical |titre chapitre=Marine Plants: A Unique and Unexplored Resource |titre ouvrage=Plants: the potentials for extracting protein, medicines, and other useful chemicals (workshop proceedings) |éditeur= |
Dans la nature, le dioxygène à l'état libre est produit par [[photolyse]] de l'[[eau]] grâce à la [[photosynthèse]]. D'après certaines estimations, les [[algue verte|algues vertes]] et les [[cyanobacteria|cyanobactéries]] présentes en [[Océan|milieu marin]] fournissent environ 70 % du dioxygène à l'état libre produit sur Terre, le reste étant produit par les [[plante]]s terrestres<ref>{{Chapitre |langue=en |prénom1=William |nom1=Fenical |titre chapitre=Marine Plants: A Unique and Unexplored Resource |titre ouvrage=Plants: the potentials for extracting protein, medicines, and other useful chemicals (workshop proceedings) |éditeur=Diane Publishing |année=1983 |mois=septembre |passage=147 |lire en ligne=https://books.google.com/?id=g6RfkqCUQyQC&pg=PA147 |isbn=1-4289-2397-7}}.</ref>. D'autres estimations affirment que la contribution des océans à l'apport d'oxygène atmosphérique est plus importante, mais d'autres encore affirment le contraire, suggérant que les océans produisent environ 45 % du dioxygène atmosphérique chaque année<ref>{{Ouvrage |langue=en |prénom1=J. C. G. |nom1=Walker |titre=The oxygen cycle in the natural environment and the biogeochemical cycles |éditeur=[[Springer Science+Business Media|Springer-Verlag]] |année=1980 |isbn=}}.</ref>. |
||
Une formule globale et simplifiée traduisant la photosynthèse s'écrit<ref>{{Ouvrage |langue=en |prénom1=Theodore L. |nom1=Brown |prénom2=Burslen |nom2=LeMay |titre=Chemistry |sous-titre=The Central Science |éditeur=Prentice Hall/Pearson Education |année=2003 |passage=958 |isbn=0-13-048450-4 |consulté le=28 juin 2013}}.</ref> :{{retrait|1= 6 {{CO2}} + 6 {{H2O}} + [[photon]]s → {{formule chimique|C|6|H|12|O|6}} + 6 {{O2}}}} |
Une formule globale et simplifiée traduisant la photosynthèse s'écrit<ref>{{Ouvrage |langue=en |prénom1=Theodore L. |nom1=Brown |prénom2=Burslen |nom2=LeMay |titre=Chemistry |sous-titre=The Central Science |éditeur=[[Prentice Hall]]/[[Pearson (maison d'édition)|Pearson Education]] |année=2003 |passage=958 |isbn=0-13-048450-4 |consulté le=28 juin 2013}}.</ref> :{{retrait|1= 6 {{CO2}} + 6 {{H2O}} + [[photon]]s → {{formule chimique|C|6|H|12|O|6}} + 6 {{O2}}}} |
||
ou simplement : {{retrait|1= [[dioxyde de carbone]] + eau + [[Rayonnement solaire|lumière solaire]] → [[glucose]] + dioxygène.}} |
ou simplement : {{retrait|1= [[dioxyde de carbone]] + eau + [[Rayonnement solaire|lumière solaire]] → [[glucose]] + dioxygène.}} |
||
L'évolution photolytique du dioxygène se produit dans la [[thylakoïde]] des organismes photosynthétiques et requiert l'énergie de quatre [[photon]]s. Beaucoup d'étapes sont complexes mais le résultat aboutit la formation d'un [[gradient électrochimique]] au travers de la thilakoïde qui est utilisé pour synthétiser l'[[adénosine triphosphate]] (ATP) via le processus de [[photophosphorylation]]<ref name="Raven">{{Ouvrage |langue=en |prénom1=Peter H. |nom1=Raven |lien auteur1=Peter Hamilton Raven |prénom2=Ray F. |nom2=Evert |prénom3=Susan E. |nom3=Eichhorn |titre=Biology of Plants, 7th Edition |éditeur=W.H. Freeman and Company |
L'évolution photolytique du dioxygène se produit dans la [[thylakoïde]] des organismes photosynthétiques et requiert l'énergie de quatre [[photon]]s. Beaucoup d'étapes sont complexes mais le résultat aboutit la formation d'un [[gradient électrochimique]] au travers de la thilakoïde qui est utilisé pour synthétiser l'[[adénosine triphosphate]] (ATP) via le processus de [[photophosphorylation]]<ref name="Raven">{{Ouvrage |langue=en |prénom1=Peter H. |nom1=Raven |lien auteur1=Peter Hamilton Raven |prénom2=Ray F. |nom2=Evert |prénom3=Susan E. |nom3=Eichhorn |titre=Biology of Plants, 7th Edition |éditeur=[[W. H. Freeman and Company]] |lieu=New York |année=2005 |passage=115-27 |isbn=0-7167-1007-2}}.</ref>. Le dioxygène restant après l'oxydation de la [[molécule d'eau]] est rejeté dans l'atmosphère. |
||
=== Respiration === |
=== Respiration === |
||
Le dioxygène est essentiel dans la [[respiration cellulaire]] chez tous les organismes [[aérobie]]s. Les [[mitochondrie]]s l'utilisent pour aider à la production d'ATP pendant le processus de [[phosphorylation oxydative]]. La réaction modélisant la [[respiration aérobie]] est globalement l'inverse de celle modélisant la photosynthèse et s'écrit de façon simplifiée et dans le cas |
Le dioxygène est essentiel dans la [[respiration cellulaire]] chez tous les organismes [[aérobie]]s. Les [[mitochondrie]]s l'utilisent pour aider à la production d'ATP pendant le processus de [[phosphorylation oxydative]]. La réaction modélisant la [[respiration aérobie]] est globalement l'inverse de celle modélisant la [[photosynthèse]] et s'écrit de façon simplifiée et dans le cas de l'oxydation du [[glucose]] avec un rendement de 100 %<ref name=":0">{{Lien web |url=http://esamultimedia.esa.int/docs/edu/dvdlessons/lessonnotes/ESADVDLessonNotes_Francais.pdf |titre=Les ingrédients de la vie sur Terre et dans l'espace |éditeur=[[Agence spatiale européenne]] |page=3 |consulté le=28 juin 2013}}.</ref> : {{retrait|1= {{formule chimique|C|6|H|12|O|6}} + 6 {{O2}} → 6 {{CO2}} + 6 {{H2O}} + {{unité|2880 kJ/mol}}.}} En réalité, de l'énergie est utilisée pendant la formation de l'ATP (la molécule qui permet le stockage de l'énergie dans la cellule) à partir d'ADP ainsi que pour permettre le transport des molécules nécessaires à cette réaction au sein de la cellule. Ainsi l'énergie effectivement stockée sous forme d'ATP et donc utilisable par le corps est plutôt de {{unité|1162.8 kJ}} pour une mole de glucose consommée, c'est-à-dire<ref name=":0" />:{{retrait|1= {{formule chimique|C|6|H|12|O|6}} + 6 {{O2}} → 6 {{CO2}} + 6 {{H2O}} + {{unité|1162.8 kJ/mol}}.}} Chez les [[vertébré]]s, le dioxygène [[Diffusion de la matière|diffuse]] à travers les membranes des cellules dans les poumons et les [[Érythrocyte|globules rouges]]. L'[[hémoglobine]] se lie au dioxygène et provoque un changement de couleur de la protéine qui passe du rouge bleuté au rouge vif<ref>{{Ouvrage |langue=en |prénom1=Albert |nom1=Stwertka |titre=Guide to the Elements |éditeur=[[Oxford University Press]] |année=1998 |pages totales=240 |passage=48-49 |isbn=0-19-508083-1}}.</ref>{{,}}{{note|groupe=alpha|Le dioxyde de carbone est libéré d'une autre partie de l'hémoglobine via l'[[effet Bohr]].}}. D'autres animaux n'utilisent pas l'hémoglobine pour le transport du dioxygène : les [[mollusque]]s et certains [[arthropode]]s utilisent l'[[hémocyanine]] tandis que les [[araignée]]s et les [[homard]]s utilisent l'[[hémérythrine]]<ref name="Livre 1">{{Ouvrage |langue=en |prénom1=John |nom1=Emsley |titre=Nature's Building Blocks |sous-titre=An A-Z Guide to the Elements |éditeur=[[Oxford University Press]] |lieu=Oxford, Angleterre |année=2001 |pages totales=538 |passage=297-304 |isbn=0-19-850340-7 |lire en ligne=https://books.google.com/books?id=j-Xu07p3cKwC&printsec=frontcover}}.</ref>. Un litre de sang peut dissoudre {{unité|200 cm3}} de dioxygène<ref name="Livre 1" />. |
||
Les [[dérivé réactif de l'oxygène|dérivés réactifs de l'oxygène]], comme l'ion [[superoxyde]] {{O2}}{{exp| |
Les [[dérivé réactif de l'oxygène|dérivés réactifs de l'oxygène]], comme l'ion [[superoxyde]] {{O2}}{{exp|−}} et le [[peroxyde d'hydrogène]] {{formule chimique|H|2|O|2}}, sont des sous-produits toxiques du dioxygène utilisés par les organismes<ref name="Livre 1"/>. Toutefois, certaines parties du système immunitaire des organismes évolués produisent du peroxyde, du superoxyde et de l'[[oxygène singulet]] pour éliminer les [[micro-organisme]]s envahisseurs<ref>{{Ouvrage |langue originale=en |prénom1=Charles A. |nom1=Janeway |prénom2=Paul |nom2=Travers |titre=Immunobiologie |sous-titre=le système immunitaire fondamental et pathologique |éditeur=[[De Boeck]] |lieu=Paris/Bruxelles |année=2003 |pages totales=784 |passage=41 |isbn=2-7445-0150-6 |consulté le=28 juin 2013}}.</ref>. Les dérivés réactifs du dioxygène jouent également un rôle important dans la [[réponse hypersensitive]] des plantes contre les attaques pathogènes<ref name="Raven"/>. |
||
Un adulte au repos inhale entre 1,8 et |
Un adulte au repos inhale entre 1,8 et 2,4 grammes d'oxygène par minute<ref>{{Lien web |langue=en |url=http://www.patentstorm.us/patents/6224560-description.html |titre=Flow restrictor for measuring respiratory parameters |éditeur=Patenstorm |citation=For humans, the normal volume is 6–8 liters per minute |consulté le=28 juin 2013}}.</ref>. Cela équivaut à plus de six milliards de tonnes d'oxygène inhalées par l'humanité chaque année{{note|groupe=alpha|1=(1,8 g/min par personne) × (60 min/h) × ({{unité|24 h/j}}) × ({{unité|365 j/an}}) × ({{nobr|6,6 milliards}} de personnes) ÷ ({{unité|1000000 g/t}}) = {{nobr|6,24 milliards}} de tonnes.}}. |
||
La [[respiration aérobie]] consiste à absorber le dioxygène nécessaire au [[catabolisme]] oxydatif et à l'apport d'énergie aux cellules. Les organismes ont une capacité limite d'[[Absorption (physique)|absorption]], appelée [[consommation maximale d'oxygène]]. |
La [[respiration aérobie]] consiste à absorber le dioxygène nécessaire au [[catabolisme]] oxydatif et à l'apport d'énergie aux cellules. Les organismes ont une capacité limite d'[[Absorption (physique)|absorption]], appelée [[consommation maximale d'oxygène]]. |
||
| Ligne 232 : | Ligne 231 : | ||
=== Présence dans le corps des vertébrés === |
=== Présence dans le corps des vertébrés === |
||
C'est dans le [[système respiratoire]] que la [[pression partielle]] du dioxygène dans le corps d'un vertébré vivant est la plus élevée. Elle est plus faible dans les [[artère]]s, puis dans les tissus périphériques, et davantage encore dans les [[veine]]s. La pression partielle du dioxygène est la pression qu'aurait le dioxygène s'il occupait seul le volume considéré<ref>{{Ouvrage |langue=en |prénom1=Charles |nom1=Henrickson |titre=Chemistry |éditeur= |
C'est dans le [[système respiratoire]] que la [[pression partielle]] du dioxygène dans le corps d'un vertébré vivant est la plus élevée. Elle est plus faible dans les [[artère]]s, puis dans les tissus périphériques, et davantage encore dans les [[veine]]s. La pression partielle du dioxygène est la pression qu'aurait le dioxygène s'il occupait seul le volume considéré<ref>{{Ouvrage |langue=en |prénom1=Charles |nom1=Henrickson |titre=Chemistry |éditeur=CliffsNotes |année=2005 |pages totales=440 |isbn=0-7645-7419-1 |consulté le=28 juin 2013}}.</ref>. |
||
{|class="wikitable centre" style="text-align:center;" |
{|class="wikitable centre" style="text-align:center;" |
||
| Ligne 239 : | Ligne 238 : | ||
! Unité !! Pression du gaz dans <br> les alvéoles pulmonaires !! [[Gaz du sang]] artériel !! Gaz du sang dans les veines |
! Unité !! Pression du gaz dans <br> les alvéoles pulmonaires !! [[Gaz du sang]] artériel !! Gaz du sang dans les veines |
||
|- |
|- |
||
| [[Pascal (unité)|kPa]] || 14,2 || 11–13<ref name=mmHg>Résultat obtenu à partir de la valeur en mmHg en utilisant pour la conversion {{unité|0.133322 kPa/mmHg}}.</ref> || 4,0–5,3<ref name=mmHg/> |
| [[Pascal (unité)|kPa]] || 14,2 || 11–13<ref name="mmHg">Résultat obtenu à partir de la valeur en mmHg en utilisant pour la conversion {{unité|0.133322 kPa/mmHg}}.</ref> || 4,0–5,3<ref name="mmHg" /> |
||
|- |
|- |
||
| [[millimètre de mercure|mmHg]] || 107 || 75–100<ref>{{Lien web |langue=en |url=http://pathcuric1.swmed.edu/PathDemo/nrrt.htm |titre=Normal Reference Range Table |éditeur= |
| [[millimètre de mercure|mmHg]] || 107 || 75–100<ref>{{Lien web |langue=en |url=http://pathcuric1.swmed.edu/PathDemo/nrrt.htm |titre=Normal Reference Range Table |éditeur=[[École médicale du Sud-Ouest de l'université du Texas|University of Texas Southwestern Medical Center]] |consulté le=28 juin 2013}}.</ref> || 30–40<ref>{{Lien web |langue=en |url=http://www.brooksidepress.org/Products/OperationalMedicine/DATA/operationalmed/Lab/ABG_ArterialBloodGas.htm |titre=The Medical Education Division of the Brookside Associates → ABG (Arterial Blood Gas) |consulté le=28 juin 2013}}.</ref> |
||
|} |
|} |
||
== Structure == |
== Structure == |
||
=== Structure géométrique === |
=== Structure géométrique === |
||
La molécule est diatomique et la distance moyenne entre les deux atomes est {{unité |
La molécule est [[diatomique]] et la distance moyenne entre les deux atomes est {{unité|120.74 pm}} dans son état fondamental. |
||
Dans ses deux premiers états excités (voir la partie spectroscopie ci-dessous), cette distance augmente à {{unité|121.55 pm}} dans le premier état et à {{unité|122.77 pm}} dans le deuxième. |
Dans ses deux premiers états excités (voir la partie spectroscopie ci-dessous), cette distance augmente à {{unité|121.55 pm}} dans le premier état et à {{unité|122.77 pm}} dans le deuxième. |
||
| Ligne 263 : | Ligne 262 : | ||
Dans le cadre théorique des orbitales moléculaires ([[Combinaison linéaire d'orbitales atomiques|méthode CLOA]]), l'interaction entre deux atomes d'oxygène pour former une molécule se traduit par le diagramme ci-contre. |
Dans le cadre théorique des orbitales moléculaires ([[Combinaison linéaire d'orbitales atomiques|méthode CLOA]]), l'interaction entre deux atomes d'oxygène pour former une molécule se traduit par le diagramme ci-contre. |
||
Les deux orbitales 2s des deux atomes d'oxygène, initialement de même énergie, subissent une dégénérescence, formant une orbitale σ{{ind|2s}} liante et une orbitale σ{{expInd|*|2s}} |
Les deux orbitales 2s des deux atomes d'oxygène, initialement de même énergie, subissent une dégénérescence, formant une orbitale σ{{ind|2s}} liante et une orbitale σ{{expInd|*|2s}} antiliante, toutes deux complètement occupées, ne résultant en aucune liaison entre les deux atomes. Les six {{nobr|orbitales 2p}} des deux atomes subissent elles aussi une dégénérescence, formant trois {{nobr|orbitales σ{{ind|2px}}}}, σ{{ind|2py}} et σ{{ind|2pz}} liantes et trois {{nobr|orbitales σ{{expInd|*|2px}}}}, σ{{expInd|*|2py}} et σ{{expInd|*|2pz}} antiliantes. Les huit (2×4) {{nobr|électrons 2p}} se répartissent ainsi : |
||
* six électrons occupent les trois orbitales liantes de basse énergie ; |
* six électrons occupent les trois orbitales liantes de basse énergie ; |
||
* les deux électrons restant occupent chacun une orbitale antiliante. |
* les deux électrons restant occupent chacun une orbitale antiliante. |
||
Cette combinaison d'orbitales 2p résulte donc en trois orbitales moléculaires liantes et une antiliante, soit |
Cette combinaison d'orbitales 2p résulte donc en trois orbitales moléculaires liantes et une antiliante, soit un indice de liaison de 2. La répartition des deux électrons sur les deux orbitales antiliantes explique aussi le caractère diradicalaire du dioxygène. Cette propriété d'être radicalaire alors que le nombre d'électrons de la molécules est pair est unique parmi les molécules diatomiques. Cette répartition explique aussi le caractère paramagnétique du dioxygène, ce que ne permet pas de présager sa représentation de Lewis « classique ». |
||
Ce statut d'état triplet confère à la molécule des propriétés magnétiques (voir ci-dessous) et peut être rendu responsable de son inertie chimique à température ambiante. En effet, la réaction de {{O2}} avec une autre molécule ({{ |
Ce statut d'état triplet confère à la molécule des propriétés magnétiques (voir ci-dessous) et peut être rendu responsable de son inertie chimique à température ambiante. En effet, la réaction de {{O2}} avec une autre molécule ({{H2}}, molécules organiques) qui est presque toujours dans un état singulet pour former une molécule en état singulet se déroule sans la conservation du spin total ; c'est la cause d'une grande lenteur des réactions chimiques impliquant le dioxygène à température et pression ordinaire. |
||
=== Spectroscopie === |
=== Spectroscopie === |
||
Les deux premiers niveaux excités du dioxygène sont deux états singulets à {{unité|15800 |
Les deux premiers niveaux excités du dioxygène sont deux états singulets à {{unité|15800 cm-1}} ({{unité|94.72 kJ/mol}}) et {{unité|21100 cm-1}} ({{unité|157.85 kJ/mol}}) (voir diagramme). Ces transitions sont interdites de spin, ce qui conduit à ce que le dioxygène soit incolore. C'est le cas en phase gazeuse, la couleur bleue de l'atmosphère étant due à la [[diffusion Rayleigh]]<ref name="Greenwood">{{Harvsp|texte=''Chemistry of the Elements''|N. N. Greenwood|A. Earnshaw|1997|p=606}}.</ref>. |
||
La couleur bleue à l'état liquide (voir ci-dessous) résulte de l'absorption de deux photons à {{unité|7918 |
La couleur bleue à l'état liquide (voir ci-dessous) résulte de l'absorption de deux photons à {{unité|7918 cm-1}} sur une association de deux molécules de dioxygène ([[dimère]] O{{ind|4}}). |
||
== Magnétisme == |
== Magnétisme == |
||
Le dioxygène est [[paramagnétisme|paramagnétique]]. Cette propriété a été observée par [[Michael Faraday|Faraday]] dès 1848<ref name="Greenwood" />. Le diagramme d'[[orbitale moléculaire]] du dioxygène tracé par la [[Combinaison linéaire d'orbitales atomiques|méthode CLOA]] en rend compte. La configuration électronique contient en effet deux électrons célibataires sur les deux orbitales Π* ([[état triplet]]). |
Le dioxygène est [[paramagnétisme|paramagnétique]]. Cette propriété a été observée par [[Michael Faraday|Faraday]] dès 1848<ref name="Greenwood" />. Le diagramme d'[[orbitale moléculaire]] du dioxygène tracé par la [[Combinaison linéaire d'orbitales atomiques|méthode CLOA]] en rend compte. La configuration électronique contient en effet deux électrons célibataires sur les deux {{nobr|orbitales Π*}} ([[état triplet]]). |
||
En [[résonance magnétique nucléaire]] (RMN), pour des mesures fines, il est important de dégazer l'échantillon pour éliminer le dioxygène |
En [[résonance magnétique nucléaire]] (RMN), pour des mesures fines, il est important de dégazer l'échantillon pour éliminer le dioxygène qui est paramagnétique et va gêner la détection en provoquant un élargissement des pics. Ce dégazage est, en général, accompli en faisant buller un [[gaz inerte]] (diazote ou argon) dans la solution pour remplacer les gaz dissous par ce gaz inerte et non paramagnétique. |
||
== Production == |
== Production == |
||
=== Production industrielle === |
=== Production industrielle === |
||
Le dioxygène est obtenu de manière industrielle principalement (à 95 %) par séparation [[Cryogénie|cryogénique]] des composés de l'[[air]], c'est-à-dire par une [[liquéfaction]] de l'air suivie d'une [[distillation fractionnée]]. |
Le dioxygène est obtenu de manière industrielle principalement (à 95 %) par séparation [[Cryogénie|cryogénique]] des composés de l'[[air]], c'est-à-dire par une [[liquéfaction]] de l'air suivie d'une [[distillation fractionnée]]. |
||
Les [[point critique (thermodynamique)|températures critiques]] du [[diazote]] {{ |
Les [[point critique (thermodynamique)|températures critiques]] du [[diazote]] {{N2}} (''T''{{ind|c}} = {{tmp|-146.9|°C}}) et du dioxygène {{O2}} (''T''{{ind|c}} = {{tmp|-118.4|°C}}) ne permettent pas la liquéfaction de l'air par simple [[Compression (thermodynamique)|compression]]. L'air doit donc être comprimé entre 5 et {{unité|7 bar}}, puis filtré, séché, décarbonaté par [[adsorption]] sur [[tamis moléculaire]] et enfin refroidi par échange thermique entre le gaz entrant et les gaz liquéfiés. Les pertes frigorifiques sont compensées par une [[détente (thermodynamique)|détente]] de 5 à 10 % du débit gazeux traité, dans une [[turbine]] dont le [[Travail d'une force|travail]] extérieur est récupérable. |
||
La distillation, dans le procédé le plus utilisé, est effectuée dans une double colonne qui permet d'obtenir, en continu, des gaz purs. La première colonne (moyenne pression, {{unité|5 bar}}) réalise une première séparation de l'air en diazote gazeux pur (à 99,999 %) au sommet et un liquide riche en dioxygène (environ 40 %), à la base. Ce liquide est alors envoyé à mi-hauteur de la deuxième colonne de distillation (basse pression, {{unité|1.3 bar}}). Le dioxygène |
La distillation, dans le procédé le plus utilisé, est effectuée dans une double colonne qui permet d'obtenir, en continu, des gaz purs. La première colonne (moyenne pression, {{unité|5 bar}}) réalise une première séparation de l'air en diazote gazeux pur (à 99,999 %) au sommet et un liquide riche en dioxygène (environ 40 %), à la base. Ce liquide est alors envoyé à mi-hauteur de la deuxième colonne de distillation (basse pression, {{unité|1.3 bar}}). Le dioxygène entre 99,5 % et 99,7 % est récupéré à la base de cette deuxième colonne. Il contient moins de {{unité|1 ppm}} de diazote, la principale impureté est l'[[argon]]. |
||
Les colonnes de distillation ont entre {{unité|1 et 6 m}} de diamètre, et mesurent de {{unité|15 à 25 m}} de hauteur. Elles sont en acier inoxydable ou en aluminium et comportent une centaine de plateaux. L'isolation thermique est réalisée avec de la [[Perlite (roche)|perlite]] (sable de silice expansé). Le maintien en température des colonnes ne consomme que 6 à 7 % de l'énergie totale dépensée. |
Les colonnes de distillation ont entre {{unité|1 et 6 m}} de diamètre, et mesurent de {{unité|15 à 25 m}} de hauteur. Elles sont en acier inoxydable ou en aluminium et comportent une centaine de plateaux. L'isolation thermique est réalisée avec de la [[Perlite (roche)|perlite]] (sable de silice expansé). Le maintien en température des colonnes ne consomme que 6 à 7 % de l'énergie totale dépensée. |
||
La consommation en énergie est de {{ |
La consommation en énergie est de {{unité|0.4 kWh/m3}} de dioxygène gazeux, soit de 50 à 60 % du prix de revient. |
||
Environ 5 % du dioxygène industriel est produit par un autre procédé, non cryogénique, appelé VPSA (''{{lang|en|texte=Vacuum-pressure swing adsorption}}'') ou adsorption par alternance de pression et de vide. |
Environ 5 % du dioxygène industriel est produit par un autre procédé, non cryogénique, appelé VPSA (''{{lang|en|texte=Vacuum-pressure swing adsorption}}'') ou adsorption par alternance de pression et de vide. |
||
L'air ambiant est séché et épuré par filtration, puis passe dans une colonne de [[zéolithe]]s qui adsorbent plus rapidement le diazote {{ |
L'air ambiant est séché et épuré par filtration, puis passe dans une colonne de [[zéolithe]]s qui adsorbent plus rapidement le diazote {{N2}} que le dioxygène. Les zéolites peuvent fixer dix litres de diazote par kilogramme. Lorsqu'elles sont saturées, l'air est envoyé sur une seconde colonne, pendant que le diazote de la première colonne [[Désorption|désorbe]] sous vide. La pureté du dioxygène obtenu ainsi par élimination du diazote de l'air peut atteindre 90 à 95 %. Ce dioxygène contient encore 4,5 % d'argon qui, comme le dioxygène, n'est pas adsorbé. La consommation d'énergie est de {{unité|0.4 à 0.5 kWh/m3}} de dioxygène. Cette méthode est de plus en plus employée dans les procédés industriels dont les besoins sont inférieurs à cent tonnes par jour, ainsi que dans les respirateurs utilisés à domicile. Voir aussi [[Concentrateur d'oxygène]]. |
||
Le dioxygène produit est transporté : |
Le dioxygène produit est transporté : |
||
| Ligne 305 : | Ligne 303 : | ||
En 1995, huit compagnies dans le monde fabriquaient la quasi-totalité du dioxygène industriel : |
En 1995, huit compagnies dans le monde fabriquaient la quasi-totalité du dioxygène industriel : |
||
* [[Air liquide]] (France) : 17 % ; |
* [[Air liquide]] (France) : 17 % ; |
||
* BOC (Royaume-Uni) : 14 % |
* [[Brin Oxygen Co. Ltd|BOC]] (Royaume-Uni) : 14 % (racheté par Linde en 2006) ; |
||
* [[Praxair]] (États-Unis) : 14 % ; |
* [[Praxair]] (États-Unis) : 14 % ; |
||
* [[Air Products]] (États-Unis) : 8 % ; |
* [[Air Products]] (États-Unis) : 8 % ; |
||
| Ligne 318 : | Ligne 316 : | ||
* France : 3,23 millions de tonnes. |
* France : 3,23 millions de tonnes. |
||
Dans le monde, la production totale était de l'ordre de |
Dans le monde, la production totale était de l'ordre de cent millions de tonnes en 1996, soit {{fraction|1|10}} millionième du dioxygène de l'atmosphère. |
||
=== Au laboratoire === |
=== Au laboratoire === |
||
| Ligne 340 : | Ligne 338 : | ||
De nombreux [[ion]]s de {{O2}} sont connus : |
De nombreux [[ion]]s de {{O2}} sont connus : |
||
* l'ion [[dioxygényle]], {{O2}}{{exp|+}}, dans de rares composés ; |
* l'ion [[dioxygényle]], {{O2}}{{exp|+}}, dans de rares composés ; |
||
* l'ion [[superoxyde]], {{O2}}{{exp| |
* l'ion [[superoxyde]], {{O2}}{{exp|−}}, anion fréquent dans les systèmes biologiques pour lesquels l'oxydoréduction est souvent monoélectronique ; c'est une entité peu stable ; |
||
* l'ion [[peroxyde]] {{O2}}{{exp| |
* l'ion [[peroxyde]] {{O2}}{{exp|2−}}, anion fréquent dans les peroxydes métalliques comme le [[peroxyde de baryum]] {{formule chimique|BaO|2}} ; le dioxygène a le même [[Nombre d'oxydation|degré d'oxydation]] que dans le [[peroxyde d'hydrogène]] {{Formule chimique|H|2|O|2}}. |
||
=== Réaction du dioxygène singulet {{exp|1}}{{O2}} === |
=== Réaction du dioxygène singulet {{exp|1}}{{O2}} === |
||
{{Article détaillé|Oxygène singulet}} |
{{Article détaillé|Oxygène singulet}} |
||
Le dioxygène singulet est produit par irradiation lumineuse de dioxygène triplet (son [[état fondamental]]) {{exp|3}}{{O2}} avec un photosensibilisateur. Il faut pour cela que l'[[Excitation (physique)|état excité]] de ce dernier soit supérieur à {{unité|94.7 |
Le dioxygène singulet est produit par irradiation lumineuse de dioxygène triplet (son [[état fondamental]]) {{exp|3}}{{O2}} avec un photosensibilisateur. Il faut pour cela que l'[[Excitation (physique)|état excité]] de ce dernier soit supérieur à {{unité|94.7 kJ/mol}} (voir ci-dessus la partie [[spectroscopie]]).{{retrait|1= {{exp|3}}{{O2}} + {{exp|1}}Sensibilisateur — hν → {{exp|1}}{{O2}} + {{exp|3}}Sensibilisateur.}} |
||
Le dioxygène singulet peut aussi être produit chimiquement, par exemple en solution alcoolique, avec un mélange d'eau oxygénée et d'[[eau de Javel]]<ref>{{Ouvrage|langue=en|auteur1=N. N. Greenwood|auteur2=A. Earnshaw|titre=Chemistry of the Elements|éditeur=Butterworth-Heinemann|lieu=Oxford |
Le dioxygène singulet peut aussi être produit chimiquement, par exemple en solution alcoolique, avec un mélange d'eau oxygénée et d'[[eau de Javel]]<ref>{{Ouvrage|langue=en|auteur1=N. N. Greenwood|auteur2=A. Earnshaw|titre=Chemistry of the Elements|éditeur=Butterworth-Heinemann|lieu=Oxford/Boston|année=1997|numéro d'édition=2|année première édition=1984|pages totales=1341 |passage=615 |isbn=978-0-7506-3365-9 |oclc=804401792}}.</ref> :{{retrait|1= [[Peroxyde d'hydrogène|{{Formule chimique|H|2|O|2}}]] + [[Hypochlorite|ClO{{exp|−}}]] → [[Chlorure|Cl{{exp|−}}]] + [[Eau|{{H2O}}]] + [[Oxygène singulet|{{exp|1}}{{O2}}]].}} |
||
Le dioxygène singulet est très réactif, tant chimiquement que biologiquement. |
Le dioxygène singulet est très réactif, tant chimiquement que biologiquement. |
||
| Ligne 355 : | Ligne 353 : | ||
Le dioxygène, dans l'air, est utilisé pour les combustions (chauffage, transport)<ref>Vigne J.-L., ''Données industrielles''.</ref>. |
Le dioxygène, dans l'air, est utilisé pour les combustions (chauffage, transport)<ref>Vigne J.-L., ''Données industrielles''.</ref>. |
||
Séparé du diazote, son principal usage est la [[sidérurgie]]. Le fer, en sortie des [[Haut fourneau|hauts fourneaux]], est sous forme de carbure {{Formule chimique|Fe|3|C}}, inutilisable car contenant plus de 4 % en masse de carbone. Ce |
Séparé du diazote, son principal usage est la [[sidérurgie]]. Le fer, en sortie des [[Haut fourneau|hauts fourneaux]], est sous forme de [[carbure]] {{Formule chimique|Fe|3|C}}, inutilisable car contenant plus de 4 % en masse de carbone. Ce dernier est brulé par injection de dioxygène directement dans le fer fondu. C'est le principe des [[Convertisseur (sidérurgie)|convertisseurs]]. Il faut {{unité|60 m3}} [[Conditions normales de température et de pression|CNTP]] de {{O2}} par tonne de fer. La consommation d'un site sidérurgique se chiffre en milliers de tonnes de {{O2}} par jour. |
||
La [[pétrochimie]] est également une importante consommatrice quand il est question de produire de l'[[oxyde d'éthylène]], de l'[[oxyde de propylène]], du [[chlorure de vinyle]] par [[oxychloration]], dans le raffinage des produits pétroliers, pour régénérer des |
La [[pétrochimie]] est également une importante consommatrice quand il est question de produire de l'[[oxyde d'éthylène]], de l'[[oxyde de propylène]], du [[chlorure de vinyle]] par [[oxychloration]], dans le raffinage des [[produits pétroliers]], pour régénérer des [[catalyseur]]s{{etc.}} |
||
D'autres procédés nécessitent également |
D'autres procédés nécessitent également d'importants tonnages de dioxygène : |
||
* la synthèse du [[dioxyde de titane]] par le procédé au [[dichlore]] ; |
* la synthèse du [[dioxyde de titane]] par le procédé au [[dichlore]] Cl{{ind|2}} ; |
||
* le [[Blanchiment (chimie)|blanchiment]] de la [[pâte à papier]], ce qui limite la consommation en dichlore |
* le [[Blanchiment (chimie)|blanchiment]] de la [[pâte à papier]], ce qui limite la consommation en dichlore qui reste l'agent de blanchiment principal ; |
||
* le retraitement de certains déchets chimiques par exemple, les déchets [[Soufre|soufrés]] issus de la production de [[méthacrylate de méthyle]], ce qui conduit à la récupération de {{formule chimique|lien=Acide sulfurique|H|2|SO|4}}. |
* le retraitement de certains déchets chimiques par exemple, les déchets [[Soufre|soufrés]] issus de la production de [[méthacrylate de méthyle]], ce qui conduit à la récupération de {{formule chimique|lien=Acide sulfurique|H|2|SO|4}}. |
||
| Ligne 371 : | Ligne 369 : | ||
<gallery widths="180px" heights="180px"> |
<gallery widths="180px" heights="180px"> |
||
Schéma LD métallurgie.svg |
Schéma LD métallurgie.svg|Schéma d'un convertisseur avec l'apport de dioxygène directement dans le métal fondu. |
||
GwangyangIronworks.jpg|Convertisseur en fonctionnement ; la réaction du fer fondu avec le dioxygène produit des gerbes de lumière. |
GwangyangIronworks.jpg|Convertisseur en fonctionnement ; la réaction du fer fondu avec le dioxygène produit des gerbes de lumière. |
||
Oxygène médical en bouteille.jpg|Dioxygène médical en bouteille. |
Oxygène médical en bouteille.jpg|Dioxygène médical en bouteille. |
||
| Ligne 377 : | Ligne 375 : | ||
== Divers == |
== Divers == |
||
Le dioxygène fait partie de la [[Liste modèle de l'OMS des médicaments essentiels|liste modèle des médicaments essentiels de l'Organisation mondiale de la santé]] (liste mise à jour en {{date-|avril 2013}})<ref>{{en}} [http://apps.who.int/iris/bitstream/10665/93142/1/EML_18_eng.pdf?ua=1 {{Lang|en|WHO |
Le dioxygène fait partie de la [[Liste modèle de l'OMS des médicaments essentiels|liste modèle des médicaments essentiels de l'Organisation mondiale de la santé]] (liste mise à jour en {{date-|avril 2013}})<ref>{{en}} [http://apps.who.int/iris/bitstream/10665/93142/1/EML_18_eng.pdf?ua=1 {{Lang|en|WHO Model List of Essential Medicines, 18th list}}], avril 2013.</ref>. |
||
== Notes et références == |
== Notes et références == |
||
| Ligne 388 : | Ligne 386 : | ||
== Voir aussi == |
== Voir aussi == |
||
=== Articles connexes === |
=== Articles connexes === |
||
{{Autres projets|wikt=dioxygène}} |
|||
* [[Oxymètre]] |
* [[Oxymètre]] |
||
* [[Isotopes de l'oxygène]] |
* [[Isotopes de l'oxygène]] |
||
| Ligne 393 : | Ligne 392 : | ||
=== Bibliographie === |
=== Bibliographie === |
||
* Davis J.C. (1975), ''Waterborne dissolved oxygen requirements and criteria with particular emphasis on the Canadian environment'', dans |
* {{en}} Davis J.C. (1975), ''Waterborne dissolved oxygen requirements and criteria with particular emphasis on the Canadian environment'', dans Associate Committee on Scientific Criteria for Quality, National. |
||
=== Liens externes === |
|||
{{Liens}} |
|||
{{Palette|Éléments diatomiques|Oxygène}} |
{{Palette|Éléments diatomiques|Oxygène}} |
||
Dernière version du 21 avril 2024 à 17:40
| Dioxygène | |
| |
| Représentations du dioxygène. | |
| Identification | |
|---|---|
| Nom UICPA | dioxygène |
| Synonymes |
oxygène moléculaire |
| No CAS | |
| No ECHA | 100.029.051 |
| No CE | 231-956-9 |
| Code ATC | V03 |
| PubChem | 977 |
| No E | E948 |
| SMILES | |
| InChI | |
| Apparence | gaz incolore à température et pression ambiante ; gaz liquéfié : liquide incolore à bleu[1] |
| Propriétés chimiques | |
| Formule | O2 [Isomères] |
| Masse molaire[2] | 31,998 8 ± 0,000 6 g/mol O 100 %, |
| Diamètre moléculaire | 0,292 nm |
| Propriétés physiques | |
| T° fusion | −219 °C[3] |
| T° ébullition | −183 °C[3] |
| Solubilité | dans l'eau à 20 °C : 3,1 ml/100 ml[1], 14,6 mg l−1 (eau à 0 °C), |
| Masse volumique | |
| Pression de vapeur saturante | à −118 °C : 5 080 kPa[1]
|
| Point critique | −118,67 °C 50,422 bar 0,636 1 kg l−1[3] |
| Point triple | −218,791 6 °C[5] 0,001 49 bar[3] |
| Vitesse du son | 330 m s−1 (27 °C, 1 atm)[6] |
| Thermochimie | |
| ΔfusH° | 213 kJ/kg |
| ΔvapH° | 6,82 kJ/mol (1 atm, −182,95 °C)[7] |
| Cp | |
| Précautions | |
| SGH[8] | |
| H270 |
|
| SIMDUT[9] | |
  A, C, |
|
| NFPA 704 | |
| Transport | |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le dioxygène, communément nommé oxygène, est une substance constituée de molécules O2 (constituées chacune de deux atomes d'oxygène). Gazeux dans les conditions normales de température et de pression, incolore, inodore et insipide, il participe à des réactions d'oxydoréduction, essentiellement la combustion, la corrosion et la respiration. Le dioxygène est l'une des formes allotropiques de l'oxygène.
L'appellation « oxygène » sans autre précision est ambiguë parce que ce terme peut désigner l'élément oxygène (O) ou le gaz oxygène (O2)[a].
Découvert indépendamment en 1772 par le Suédois Carl Wilhelm Scheele à Uppsala, et en 1774 par le Britannique Joseph Priestley dans le Wiltshire, l'oxygène a été nommé ainsi en 1777 par le Français Antoine Lavoisier à Paris à partir du grec ancien ὀξύς / oxús (« aigu », c'est-à-dire ici « acide »), et γενής / genếs (« générateur »), car Lavoisier pensait à tort — oxydation et acidification étant reliées — que[10] :
« Nous avons donné à la base de la portion respirable de l'air le nom d'oxygène, en le dérivant de deux mots grecs ὀξύς, acide et γείνομαι, j'engendre, parce qu'en effet une des propriétés les plus générales de cette base [Lavoisier parle de l'oxygène] est de former des acides en se combinant avec la plupart des substances. Nous appellerons donc gaz oxygène la réunion de cette base avec le calorique. »
Constituant 20,95 % en volume de l'atmosphère terrestre (23,2 % en masse), le dioxygène est un gaz indispensable à la plupart des formes de vie actuelles, auxquelles il fournit le comburant nécessaire au fonctionnement des cellules (respiration cellulaire). Dans l'environnement aquatique, le dioxygène dissous est également nécessaire à la vie de très nombreuses espèces (comme les poissons)[11]. Seules les archées et une fraction minoritaire des bactéries (dites anaérobies), peuvent se passer du dioxygène. Ce sont les bactéries anaérobies productrices de dioxygène qui ont oxydé l'atmosphère primitive initialement réductrice, puis l'ont enrichie en dioxygène : ce dernier est présent en abondance dans l'air depuis la Grande Oxydation, il y a environ 2,4 milliards d'années.
Origine et évolution du dioxygène de l'atmosphère terrestre[modifier | modifier le code]
De nombreuses hypothèses ont été avancées pour expliquer la présence de dioxygène dans l'atmosphère :
- la plus communément retenue est qu'il s'agit d'un gaz produit lors du fonctionnement des cyanobactéries, et plus généralement des végétaux chlorophylliens, extrayant le carbone du dioxyde de carbone (sous forme de composés organiques) et rejetant l'oxygène (sous forme de dioxygène) par le mécanisme de la photosynthèse ;
- une seconde invoque la décomposition, dans la haute atmosphère, de molécules d'eau en dioxygène et dihydrogène, sous l'effet des rayonnements solaire et cosmique. Le dihydrogène s'échappant définitivement dans l'espace (au rythme, actuellement, d'environ 3 kg/s), le dioxygène s'accumule dans l'atmosphère.
Les deux phénomènes existants, la réalité peut être une combinaison des deux processus.
Cyanobactéries[modifier | modifier le code]
Il y a quatre milliards d'années, la Terre est presque totalement recouverte d'eau et son atmosphère est composée de méthane, d'ammoniac et de dioxyde de carbone[12]. Les premières bactéries présentes dans l'océan utilisent exclusivement la fermentation comme source d'énergie. Peu à peu en évoluant, elles deviennent capables d'utiliser la lumière solaire comme source d'énergie, le CO2 comme source de carbone et l'H2O ou l'H2S comme source d'hydrogène. C'est l'apparition de la photosynthèse. Ces organismes autotrophes, c'est-à-dire capables de créer leurs propres nutriments, vont se développer, se propager et muter en cyanobactéries il y a 3,2 milliards d'années.
Ces cyanobactéries utilisent l'eau comme source d'hydrogène et rejettent du dioxygène dans leur milieu, un poison mortel pour toutes les autres bactéries anaérobies. Cette compétition autour du dioxygène entre les bactéries est un tournant décisif dans l'évolution de la vie. La prolifération des cyanobactéries modifie totalement la composition de l'atmosphère et des océans en les enrichissant en dioxygène. En parallèle, des bactéries évoluent pour pouvoir utiliser ce dioxygène dans leur métabolisme à la place de la fermentation, ce sont les premiers organismes à réaliser la respiration cellulaire. En effet, les rendements énergétiques de la respiration sont bien supérieurs à la fermentation, donnant à ces êtres vivants un avantage évolutif des plus importants.
Il y a environ deux milliards d'années, une cellule eucaryote primitive (anaérobie) avale une bactérie capable de réaliser la respiration. Cette bactérie internalisée par phagocytose deviendra la mitochondrie, actuellement présente dans toutes les cellules aérobies. À noter que les mitochondries ont leur propre ADN, possédant toutes les caractéristiques d'un ADN dit bactérien (ADN circulaire).
Évolution du taux de dioxygène dans l'atmosphère terrestre[modifier | modifier le code]

| Étape | Période (Ga) | Caractéristiques |
|---|---|---|
| 1[14] | 3,85–2,45 | Pas de production d'O2 jusqu'à 3,5 Ga puis production par des procaryotes autotrophes, l'O2 étant consommé par les « puits à oxygène » sous-marins, formant notamment les formations ferrifères rubanées. |
| 2[15] | 2,45–1,85 | La séquestration de l'O2 dans ces puits sous-marins commence à diminuer, ce qui initie la catastrophe de l'oxygène. L'O2 qui s'échappe dans l'atmosphère est toxique pour les procaryotes anaérobies et est un gaz corrosif qui, en attaquant les roches, est à l'origine de 2 500 des 4 500 minéraux actuellement présents sur terre. |
| 3[16] | 1,85–0,85 | Les océans dégagent de l'O2 mais il est absorbé par les lits rouges (en) et la constitution de la couche d'ozone. |
| 4[17] et 5[18] | 0,85–0,54 0,54–présent | Les puits d'O2 sont saturés et l'O2 s'accumule dans l'atmosphère. |
Le dioxygène était quasiment inexistant dans l'atmosphère terrestre avant que les archées et les bactéries ne se développent, probablement il y a environ 3,5 milliards d'années. Le dioxygène à l'état libre apparaît pour la première fois en quantité significative durant le paléoprotérozoïque (il y a entre 2,5 et 1,6 milliard d'années environ). Pendant le premier milliard d'années, tout le dioxygène produit par ces organismes se combine à du fer dissous dans les océans pour former des formations ferrifères rubanées. Quand ces puits d'oxygène sont saturés, le dioxygène libre commence à être relargué des océans, il y a 2,7 milliards d'années. Sa concentration atteint 10 % de son niveau actuel il y a environ 1,7 milliard d'années[19].
La présence d'une grande quantité de dioxygène dissous dans les océans et dans l'atmosphère peut avoir conduit à l'extinction les organismes anaérobies qui vivent alors, au cours de la crise écologique nommée la Grande Oxydation il y a environ 2,4 milliards d'années. Toutefois, la respiration cellulaire utilisant le dioxygène permet aux organismes aérobies de produire beaucoup plus d'adénosine triphosphate (ATP) que les organismes anaérobies, les aidant ainsi à dominer la biosphère terrestre[20].
Depuis le début du Cambrien il y a 540 millions d'années, la concentration d'oxygène dans l'atmosphère a évolué, représentant au fil du temps entre 15 % et 30 % de son volume[21]. Vers la fin du Carbonifère il y a environ 300 millions d'années, le taux de dioxygène atmosphérique atteint un maximum : il représente alors 35 % du volume de l'atmosphère[21] ce qui pourrait avoir contribué à la grande taille des insectes et des amphibiens de l'époque[22]. Cette culmination de sa proportion dans l'atmosphère terrestre à cette époque est due à l'expansion massive des forêts de fougères géantes sur la Pangée, et à l'enfouissement progressif des produits organiques qui sont devenus les gisements de charbon[21]. Les activités humaines, y compris la combustion de sept milliards de tonnes de combustibles fossiles chaque année ont un très faible impact sur la quantité d'oxygène libre dans l'atmosphère[23]. Au rythme actuel de la photosynthèse, il faudrait environ deux mille ans pour produire la totalité du dioxygène présent aujourd'hui dans l'atmosphère[24].
Rôles biologiques[modifier | modifier le code]
Photosynthèse[modifier | modifier le code]
Dans la nature, le dioxygène à l'état libre est produit par photolyse de l'eau grâce à la photosynthèse. D'après certaines estimations, les algues vertes et les cyanobactéries présentes en milieu marin fournissent environ 70 % du dioxygène à l'état libre produit sur Terre, le reste étant produit par les plantes terrestres[25]. D'autres estimations affirment que la contribution des océans à l'apport d'oxygène atmosphérique est plus importante, mais d'autres encore affirment le contraire, suggérant que les océans produisent environ 45 % du dioxygène atmosphérique chaque année[26].
Une formule globale et simplifiée traduisant la photosynthèse s'écrit[27] :6 CO2 + 6 H2O + photons → C6H12O6 + 6 O2
ou simplement : dioxyde de carbone + eau + lumière solaire → glucose + dioxygène.
L'évolution photolytique du dioxygène se produit dans la thylakoïde des organismes photosynthétiques et requiert l'énergie de quatre photons. Beaucoup d'étapes sont complexes mais le résultat aboutit la formation d'un gradient électrochimique au travers de la thilakoïde qui est utilisé pour synthétiser l'adénosine triphosphate (ATP) via le processus de photophosphorylation[28]. Le dioxygène restant après l'oxydation de la molécule d'eau est rejeté dans l'atmosphère.
Respiration[modifier | modifier le code]
Le dioxygène est essentiel dans la respiration cellulaire chez tous les organismes aérobies. Les mitochondries l'utilisent pour aider à la production d'ATP pendant le processus de phosphorylation oxydative. La réaction modélisant la respiration aérobie est globalement l'inverse de celle modélisant la photosynthèse et s'écrit de façon simplifiée et dans le cas de l'oxydation du glucose avec un rendement de 100 %[29] : C6H12O6 + 6 O2 → 6 CO2 + 6 H2O + 2 880 kJ/mol. En réalité, de l'énergie est utilisée pendant la formation de l'ATP (la molécule qui permet le stockage de l'énergie dans la cellule) à partir d'ADP ainsi que pour permettre le transport des molécules nécessaires à cette réaction au sein de la cellule. Ainsi l'énergie effectivement stockée sous forme d'ATP et donc utilisable par le corps est plutôt de 1 162,8 kJ pour une mole de glucose consommée, c'est-à-dire[29]:C6H12O6 + 6 O2 → 6 CO2 + 6 H2O + 1 162,8 kJ/mol. Chez les vertébrés, le dioxygène diffuse à travers les membranes des cellules dans les poumons et les globules rouges. L'hémoglobine se lie au dioxygène et provoque un changement de couleur de la protéine qui passe du rouge bleuté au rouge vif[30],[b]. D'autres animaux n'utilisent pas l'hémoglobine pour le transport du dioxygène : les mollusques et certains arthropodes utilisent l'hémocyanine tandis que les araignées et les homards utilisent l'hémérythrine[23]. Un litre de sang peut dissoudre 200 cm3 de dioxygène[23].
Les dérivés réactifs de l'oxygène, comme l'ion superoxyde O2− et le peroxyde d'hydrogène H2O2, sont des sous-produits toxiques du dioxygène utilisés par les organismes[23]. Toutefois, certaines parties du système immunitaire des organismes évolués produisent du peroxyde, du superoxyde et de l'oxygène singulet pour éliminer les micro-organismes envahisseurs[31]. Les dérivés réactifs du dioxygène jouent également un rôle important dans la réponse hypersensitive des plantes contre les attaques pathogènes[28].
Un adulte au repos inhale entre 1,8 et 2,4 grammes d'oxygène par minute[32]. Cela équivaut à plus de six milliards de tonnes d'oxygène inhalées par l'humanité chaque année[c].
La respiration aérobie consiste à absorber le dioxygène nécessaire au catabolisme oxydatif et à l'apport d'énergie aux cellules. Les organismes ont une capacité limite d'absorption, appelée consommation maximale d'oxygène.
La consommation de dioxygène est un indice d'activité cellulaire. Cette remarque est à l'origine d'une caractérisation de la pollution biodégradable d'un échantillon d'eau, la demande biologique en oxygène.
Présence dans le corps des vertébrés[modifier | modifier le code]
C'est dans le système respiratoire que la pression partielle du dioxygène dans le corps d'un vertébré vivant est la plus élevée. Elle est plus faible dans les artères, puis dans les tissus périphériques, et davantage encore dans les veines. La pression partielle du dioxygène est la pression qu'aurait le dioxygène s'il occupait seul le volume considéré[33].
| Unité | Pression du gaz dans les alvéoles pulmonaires |
Gaz du sang artériel | Gaz du sang dans les veines |
|---|---|---|---|
| kPa | 14,2 | 11–13[34] | 4,0–5,3[34] |
| mmHg | 107 | 75–100[35] | 30–40[36] |
Structure[modifier | modifier le code]
Structure géométrique[modifier | modifier le code]
La molécule est diatomique et la distance moyenne entre les deux atomes est 120,74 pm dans son état fondamental.
Dans ses deux premiers états excités (voir la partie spectroscopie ci-dessous), cette distance augmente à 121,55 pm dans le premier état et à 122,77 pm dans le deuxième.
Représentation de Lewis[modifier | modifier le code]
La représentation courante de Lewis du dioxygène, afin que ses deux atomes respectent la règle de l'octet, est une liaison double, chaque atome portant en outre deux doublets d'électrons non partagés. Cependant, cette structure ne rend pas compte du paramagnétisme de cette molécule. Il est possible de proposer un schéma de Lewis qui respecte cette observation expérimentale avec une liaison simple (et non une liaison double) et un électron célibataire par atome d'oxygène.
La représentation peu classique, avec une simple liaison, présente l'inconvénient de ne pas rendre compte de la courte distance de liaison (d = 120,74 pm), bien plus courte qu'une liaison simple O-O comme dans le peroxyde d'hydrogène H-O-O-H pour lequel la longueur de liaison est 145,7 pm. Cela explique en particulier pourquoi, dans la pratique, cette structure n'est utilisée qu'à titre pédagogique, pour mettre l'accent sur le caractère diradicalaire de la molécule. Une description plus performante est obtenue avec les orbitales moléculaires.
Diagramme d'orbitales moléculaires[modifier | modifier le code]


Dans le cadre théorique des orbitales moléculaires (méthode CLOA), l'interaction entre deux atomes d'oxygène pour former une molécule se traduit par le diagramme ci-contre.
Les deux orbitales 2s des deux atomes d'oxygène, initialement de même énergie, subissent une dégénérescence, formant une orbitale σ2s liante et une orbitale σ*
2s antiliante, toutes deux complètement occupées, ne résultant en aucune liaison entre les deux atomes. Les six orbitales 2p des deux atomes subissent elles aussi une dégénérescence, formant trois orbitales σ2px, σ2py et σ2pz liantes et trois orbitales σ*
2px, σ*
2py et σ*
2pz antiliantes. Les huit (2×4) électrons 2p se répartissent ainsi :
- six électrons occupent les trois orbitales liantes de basse énergie ;
- les deux électrons restant occupent chacun une orbitale antiliante.
Cette combinaison d'orbitales 2p résulte donc en trois orbitales moléculaires liantes et une antiliante, soit un indice de liaison de 2. La répartition des deux électrons sur les deux orbitales antiliantes explique aussi le caractère diradicalaire du dioxygène. Cette propriété d'être radicalaire alors que le nombre d'électrons de la molécules est pair est unique parmi les molécules diatomiques. Cette répartition explique aussi le caractère paramagnétique du dioxygène, ce que ne permet pas de présager sa représentation de Lewis « classique ».
Ce statut d'état triplet confère à la molécule des propriétés magnétiques (voir ci-dessous) et peut être rendu responsable de son inertie chimique à température ambiante. En effet, la réaction de O2 avec une autre molécule (H2, molécules organiques) qui est presque toujours dans un état singulet pour former une molécule en état singulet se déroule sans la conservation du spin total ; c'est la cause d'une grande lenteur des réactions chimiques impliquant le dioxygène à température et pression ordinaire.
Spectroscopie[modifier | modifier le code]
Les deux premiers niveaux excités du dioxygène sont deux états singulets à 15 800 cm−1 (94,72 kJ/mol) et 21 100 cm−1 (157,85 kJ/mol) (voir diagramme). Ces transitions sont interdites de spin, ce qui conduit à ce que le dioxygène soit incolore. C'est le cas en phase gazeuse, la couleur bleue de l'atmosphère étant due à la diffusion Rayleigh[37].
La couleur bleue à l'état liquide (voir ci-dessous) résulte de l'absorption de deux photons à 7 918 cm−1 sur une association de deux molécules de dioxygène (dimère O4).
Magnétisme[modifier | modifier le code]
Le dioxygène est paramagnétique. Cette propriété a été observée par Faraday dès 1848[37]. Le diagramme d'orbitale moléculaire du dioxygène tracé par la méthode CLOA en rend compte. La configuration électronique contient en effet deux électrons célibataires sur les deux orbitales Π* (état triplet).
En résonance magnétique nucléaire (RMN), pour des mesures fines, il est important de dégazer l'échantillon pour éliminer le dioxygène qui est paramagnétique et va gêner la détection en provoquant un élargissement des pics. Ce dégazage est, en général, accompli en faisant buller un gaz inerte (diazote ou argon) dans la solution pour remplacer les gaz dissous par ce gaz inerte et non paramagnétique.
Production[modifier | modifier le code]
Production industrielle[modifier | modifier le code]
Le dioxygène est obtenu de manière industrielle principalement (à 95 %) par séparation cryogénique des composés de l'air, c'est-à-dire par une liquéfaction de l'air suivie d'une distillation fractionnée.
Les températures critiques du diazote N2 (Tc = −146,9 °C) et du dioxygène O2 (Tc = −118,4 °C) ne permettent pas la liquéfaction de l'air par simple compression. L'air doit donc être comprimé entre 5 et 7 bar, puis filtré, séché, décarbonaté par adsorption sur tamis moléculaire et enfin refroidi par échange thermique entre le gaz entrant et les gaz liquéfiés. Les pertes frigorifiques sont compensées par une détente de 5 à 10 % du débit gazeux traité, dans une turbine dont le travail extérieur est récupérable.
La distillation, dans le procédé le plus utilisé, est effectuée dans une double colonne qui permet d'obtenir, en continu, des gaz purs. La première colonne (moyenne pression, 5 bar) réalise une première séparation de l'air en diazote gazeux pur (à 99,999 %) au sommet et un liquide riche en dioxygène (environ 40 %), à la base. Ce liquide est alors envoyé à mi-hauteur de la deuxième colonne de distillation (basse pression, 1,3 bar). Le dioxygène entre 99,5 % et 99,7 % est récupéré à la base de cette deuxième colonne. Il contient moins de 1 ppm de diazote, la principale impureté est l'argon.
Les colonnes de distillation ont entre 1 et 6 m de diamètre, et mesurent de 15 à 25 m de hauteur. Elles sont en acier inoxydable ou en aluminium et comportent une centaine de plateaux. L'isolation thermique est réalisée avec de la perlite (sable de silice expansé). Le maintien en température des colonnes ne consomme que 6 à 7 % de l'énergie totale dépensée.
La consommation en énergie est de 0,4 kWh/m3 de dioxygène gazeux, soit de 50 à 60 % du prix de revient.
Environ 5 % du dioxygène industriel est produit par un autre procédé, non cryogénique, appelé VPSA (Vacuum-pressure swing adsorption) ou adsorption par alternance de pression et de vide.
L'air ambiant est séché et épuré par filtration, puis passe dans une colonne de zéolithes qui adsorbent plus rapidement le diazote N2 que le dioxygène. Les zéolites peuvent fixer dix litres de diazote par kilogramme. Lorsqu'elles sont saturées, l'air est envoyé sur une seconde colonne, pendant que le diazote de la première colonne désorbe sous vide. La pureté du dioxygène obtenu ainsi par élimination du diazote de l'air peut atteindre 90 à 95 %. Ce dioxygène contient encore 4,5 % d'argon qui, comme le dioxygène, n'est pas adsorbé. La consommation d'énergie est de 0,4 à 0,5 kWh/m3 de dioxygène. Cette méthode est de plus en plus employée dans les procédés industriels dont les besoins sont inférieurs à cent tonnes par jour, ainsi que dans les respirateurs utilisés à domicile. Voir aussi Concentrateur d'oxygène.
Le dioxygène produit est transporté :
- sous forme liquide ou gazeuse par des canalisations appelées oxyducs ou oxygénoducs ;
- sous forme gazeuse comprimée dans des bouteilles ou réservoirs en acier à 200 bar ;
- sous forme liquide, en camions-citernes.
En 1995, huit compagnies dans le monde fabriquaient la quasi-totalité du dioxygène industriel :
- Air liquide (France) : 17 % ;
- BOC (Royaume-Uni) : 14 % (racheté par Linde en 2006) ;
- Praxair (États-Unis) : 14 % ;
- Air Products (États-Unis) : 8 % ;
- Nippon Sanso (Japon) : 7 % ;
- AGA (Suède) : 7 % (racheté par Linde en 2000) ;
- Messer (Allemagne) : 6 % ;
- Linde (Allemagne) : 6 %.
Les principaux pays producteurs en 1996, étaient :
- États-Unis : 27 millions de tonnes ;
- Japon : 12,7 millions de tonnes ;
- France : 3,23 millions de tonnes.
Dans le monde, la production totale était de l'ordre de cent millions de tonnes en 1996, soit 1⁄10 millionième du dioxygène de l'atmosphère.
Au laboratoire[modifier | modifier le code]
Le dioxygène a longtemps été préparé en petite quantité, au laboratoire, par réaction de chlorate de potassium avec l'acide sulfurique, ou par réaction de l'oxylithe Na2O2 avec l'eau.
Il peut être produit par la décomposition catalytique de l'eau oxygénée en présence d'oxyde de manganèse(IV) MnO2.
Ces deux derniers modes de production utilisent généralement un montage par déplacement d'eau pour recueillir le dioxygène produit.
Il peut aussi être préparé par électrolyse de l'eau pour des démonstrations pédagogiques, mais cette technique est lente et coûteuse en énergie.
Réactivité[modifier | modifier le code]
Le dioxygène est thermodynamiquement très réactif, et la plupart de ses réactions sont fortement exothermiques. Cette grande réactivité n'a généralement pas lieu à température ambiante. Les raisons cinétiques ont été détaillées ci-dessus.
Avec les corps simples[modifier | modifier le code]
Peu de corps simples ne se combinent pas directement avec le dioxygène : le tungstène W, le platine Pt, l'or Au et les gaz nobles. Il faut noter que des composés oxygénés de gaz nobles existent cependant (XeO3), mais ils n'ont jamais pu être obtenus par action directe avec O2.
Le fait que les oxydes existent pour quasiment tous les éléments chimiques a largement aidé Mendeleïev à classer les éléments (1869). Par ailleurs, le fait que certains éléments possèdent plusieurs oxydes distincts (par exemple l'azote) a été à l'origine de l'émergence de la notion d'atome par Dalton (1800).
Ions de O2[modifier | modifier le code]
De nombreux ions de O2 sont connus :
- l'ion dioxygényle, O2+, dans de rares composés ;
- l'ion superoxyde, O2−, anion fréquent dans les systèmes biologiques pour lesquels l'oxydoréduction est souvent monoélectronique ; c'est une entité peu stable ;
- l'ion peroxyde O22−, anion fréquent dans les peroxydes métalliques comme le peroxyde de baryum BaO2 ; le dioxygène a le même degré d'oxydation que dans le peroxyde d'hydrogène H2O2.
Réaction du dioxygène singulet 1O2[modifier | modifier le code]
Le dioxygène singulet est produit par irradiation lumineuse de dioxygène triplet (son état fondamental) 3O2 avec un photosensibilisateur. Il faut pour cela que l'état excité de ce dernier soit supérieur à 94,7 kJ/mol (voir ci-dessus la partie spectroscopie).3O2 + 1Sensibilisateur — hν → 1O2 + 3Sensibilisateur.
Le dioxygène singulet peut aussi être produit chimiquement, par exemple en solution alcoolique, avec un mélange d'eau oxygénée et d'eau de Javel[38] :H2O2 + ClO− → Cl− + H2O + 1O2.
Le dioxygène singulet est très réactif, tant chimiquement que biologiquement.
Utilisations[modifier | modifier le code]
Le dioxygène, dans l'air, est utilisé pour les combustions (chauffage, transport)[39].
Séparé du diazote, son principal usage est la sidérurgie. Le fer, en sortie des hauts fourneaux, est sous forme de carbure Fe3C, inutilisable car contenant plus de 4 % en masse de carbone. Ce dernier est brulé par injection de dioxygène directement dans le fer fondu. C'est le principe des convertisseurs. Il faut 60 m3 CNTP de O2 par tonne de fer. La consommation d'un site sidérurgique se chiffre en milliers de tonnes de O2 par jour.
La pétrochimie est également une importante consommatrice quand il est question de produire de l'oxyde d'éthylène, de l'oxyde de propylène, du chlorure de vinyle par oxychloration, dans le raffinage des produits pétroliers, pour régénérer des catalyseurs, etc.
D'autres procédés nécessitent également d'importants tonnages de dioxygène :
- la synthèse du dioxyde de titane par le procédé au dichlore Cl2 ;
- le blanchiment de la pâte à papier, ce qui limite la consommation en dichlore qui reste l'agent de blanchiment principal ;
- le retraitement de certains déchets chimiques par exemple, les déchets soufrés issus de la production de méthacrylate de méthyle, ce qui conduit à la récupération de H2SO4.
Les autres usages ponctuels sont par exemple :
- la production de flammes à haute température, comme celle du chalumeau oxhydrique ;
- comme gaz médical :
- oxygénothérapie normobare (à pression atmosphérique) : dans l'assistance respiratoire de personnes ayant des difficultés respiratoires (maladies telles que l'asthme ou l'insuffisance respiratoire chronique, ou lors d'une anesthésie), pour la ventilation artificielle (arrêt de la respiration),
- oxygénothérapie hyperbare (à haute pression) : pour le traitement de certaines intoxications au gaz (notamment au monoxyde de carbone), des accidents de décompression en plongée ou de certaines brûlures, de certaines pathologies artéritiques.
-
Schéma d'un convertisseur avec l'apport de dioxygène directement dans le métal fondu.
-
Convertisseur en fonctionnement ; la réaction du fer fondu avec le dioxygène produit des gerbes de lumière.
-
Dioxygène médical en bouteille.
Divers[modifier | modifier le code]
Le dioxygène fait partie de la liste modèle des médicaments essentiels de l'Organisation mondiale de la santé (liste mise à jour en )[40].
Notes et références[modifier | modifier le code]
Notes[modifier | modifier le code]
- La même ambiguïté concerne de nombreux autres éléments (hydrogène, azote, chlore, etc.).
- Le dioxyde de carbone est libéré d'une autre partie de l'hémoglobine via l'effet Bohr.
- (1,8 g/min par personne) × (60 min/h) × (24 h/j) × (365 j/an) × (6,6 milliards de personnes) ÷ (1 000 000 g/t) = 6,24 milliards de tonnes.
Références[modifier | modifier le code]
- OXYGENE et OXYGENE (LIQUEFIED), Fiches internationales de sécurité chimique .
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Entrée du numéro CAS « 7782-44-7 » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 28 janvier 2009 (JavaScript nécessaire).
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, États-Unis, McGraw-Hill, , 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50.
- Procès-verbaux du Comité international des poids et mesures, 78e session, 1989, p. T1-T21 (et p. T23-T42, version anglaise).
- (en) William M. Haynes, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press/Taylor & Francis, , 91e éd., 2610 p. (ISBN 9781439820773, présentation en ligne), p. 14-40.
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press/Taylor & Francis, , 90e éd., 2804 p. (ISBN 9781420090840, présentation en ligne).
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE no 1272/2008 (16 décembre 2008).
- « Oxygène » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009.
- Lavoisier A. (1789), Traité élémentaire de chimie, 1864, p. 48.
- (en) University of Wisconsin. (2006), Dissolved oxygen:aquatic life depends on it, Water Action Volunteers-Volunteer Stream Monitoring Factsheet Series, lire en ligne (consulté le 25 février 2010).
- « Il était une fois la vie : la chimie dans l’océan terrestre il y a 4 milliards d’années », sur Encyclopédie de l'environnement, (consulté le ).
- (en) Heinrich D. Holland, « The oxygenation of the atmosphere and oceans », Phil. Trans. R. Soc. B, 361, 903–915, 19 mai 2006, DOI 10.1098/rstb.2006.1838.
- Archéen.
- Début du Protérozoïque.
- Majeure partie du Protérozoïque.
- Fin du Protérozoïque.
- Phanérozoïque.
- (en) Neil A. Campbell et Jane B. Reece, Biology, San Francisco, Pearson – Benjamin Cummings, , 7e éd., 1231 p. (ISBN 0-8053-7171-0), p. 522-23.
- (en) Scott Freeman, Biological Science, 2nd, Upper Saddle River, NJ, Pearson – Prentice Hall, (ISBN 0-13-140941-7), p. 214, 586.
- (en) Robert A. Berner, « Atmospheric oxygen over Phanerozoic time », Proceedings of the National Academy of Sciences of the USA, vol. 96, no 20, , p. 10955–57 (PMID 10500106, DOI 10.1073/pnas.96.20.10955, lire en ligne).
- DOI 10.1111/j.1472-4669.2009.00188.x
Cette citation sera générée dans quelques minutes. Vous pouvez sauter la queue ou la compléter à la main. - (en) John Emsley, Nature's Building Blocks : An A-Z Guide to the Elements, Oxford, Angleterre, Oxford University Press, , 538 p. (ISBN 0-19-850340-7, lire en ligne), p. 297-304.
- (en) Malcolm Dole, « The Natural History of Oxygen », The Journal of General Physiology, vol. 49, no 1, , p. 5-27 (PMID 5859927, DOI 10.1085/jgp.49.1.5, lire en ligne).
- (en) William Fenical, « Marine Plants: A Unique and Unexplored Resource », dans Plants: the potentials for extracting protein, medicines, and other useful chemicals (workshop proceedings), Diane Publishing, (ISBN 1-4289-2397-7, lire en ligne), p. 147.
- (en) J. C. G. Walker, The oxygen cycle in the natural environment and the biogeochemical cycles, Springer-Verlag, .
- (en) Theodore L. Brown et Burslen LeMay, Chemistry : The Central Science, Prentice Hall/Pearson Education, (ISBN 0-13-048450-4), p. 958.
- (en) Peter H. Raven, Ray F. Evert et Susan E. Eichhorn, Biology of Plants, 7th Edition, New York, W. H. Freeman and Company, (ISBN 0-7167-1007-2), p. 115-27.
- « Les ingrédients de la vie sur Terre et dans l'espace », Agence spatiale européenne (consulté le ), p. 3.
- (en) Albert Stwertka, Guide to the Elements, Oxford University Press, , 240 p. (ISBN 0-19-508083-1), p. 48-49.
- Charles A. Janeway et Paul Travers (trad. de l'anglais), Immunobiologie : le système immunitaire fondamental et pathologique, Paris/Bruxelles, De Boeck, , 784 p. (ISBN 2-7445-0150-6), p. 41.
- (en) « Flow restrictor for measuring respiratory parameters », Patenstorm (consulté le ) : « For humans, the normal volume is 6–8 liters per minute ».
- (en) Charles Henrickson, Chemistry, CliffsNotes, , 440 p. (ISBN 0-7645-7419-1).
- Résultat obtenu à partir de la valeur en mmHg en utilisant pour la conversion 0,133 322 kPa/mmHg.
- (en) « Normal Reference Range Table », University of Texas Southwestern Medical Center (consulté le ).
- (en) « The Medical Education Division of the Brookside Associates → ABG (Arterial Blood Gas) » (consulté le ).
- Chemistry of the Elements, p. 606.
- (en) N. N. Greenwood et A. Earnshaw, Chemistry of the Elements, Oxford/Boston, Butterworth-Heinemann, , 2e éd. (1re éd. 1984), 1341 p. (ISBN 978-0-7506-3365-9, OCLC 804401792), p. 615.
- Vigne J.-L., Données industrielles.
- (en) WHO Model List of Essential Medicines, 18th list, avril 2013.
Voir aussi[modifier | modifier le code]
Articles connexes[modifier | modifier le code]
Bibliographie[modifier | modifier le code]
- (en) Davis J.C. (1975), Waterborne dissolved oxygen requirements and criteria with particular emphasis on the Canadian environment, dans Associate Committee on Scientific Criteria for Quality, National.
Liens externes[modifier | modifier le code]
- Ressources relatives à la santé :
- Notices dans des dictionnaires ou encyclopédies généralistes :