« Dioxygène » : différence entre les versions
m Lien vers la page fermentation |
m Orthographe |
||
| Ligne 209 : | Ligne 209 : | ||
:: [[dioxyde de carbone]] + eau + [[Rayonnement solaire|lumière solaire]] → [[glucose]] + dioxygène. |
:: [[dioxyde de carbone]] + eau + [[Rayonnement solaire|lumière solaire]] → [[glucose]] + dioxygène. |
||
L'évolution photolytique de l'oxygène se produit dans la [[thylakoïde]] des organismes photosynthétiques et requiert l'énergie de quatre [[photon]]s. Beaucoup d'étapes sont complexes mais le résultat aboutit la formation d'un [[gradient électrochimique]] au travers de la thilakoïde qui est utilisé pour synthétiser l'[[adénosine triphosphate]] (ATP) via le processus de [[photophosphorylation]]<ref name="Raven">{{Ouvrage |langue=en |prénom1=Peter H. |nom1=Raven |prénom2=Ray F. |nom2=Evert |prénom3=Susan E. |nom3=Eichhorn |titre=Biology of Plants, 7th Edition |éditeur=W.H. Freeman and Company Publishers |lieu=New York |année=2005 |pages totales= |passage=115-27 |isbn=0-7167-1007-2}}</ref>. Le dioxygène restant après l'oxydation de la [[molécule d'eau]] est rejeté dans l'atmosphère. Le dioxygène est essentiel dans la [[respiration cellulaire]] chez tous les organismes [[aérobie]]s. Les [[mitochondrie]]s l'utilisent pour aider à la production d'ATP pendant le processus de [[phosphorylation oxydative]]. La réaction modélisant la [[respiration aérobie]] |
L'évolution photolytique de l'oxygène se produit dans la [[thylakoïde]] des organismes photosynthétiques et requiert l'énergie de quatre [[photon]]s. Beaucoup d'étapes sont complexes mais le résultat aboutit la formation d'un [[gradient électrochimique]] au travers de la thilakoïde qui est utilisé pour synthétiser l'[[adénosine triphosphate]] (ATP) via le processus de [[photophosphorylation]]<ref name="Raven">{{Ouvrage |langue=en |prénom1=Peter H. |nom1=Raven |prénom2=Ray F. |nom2=Evert |prénom3=Susan E. |nom3=Eichhorn |titre=Biology of Plants, 7th Edition |éditeur=W.H. Freeman and Company Publishers |lieu=New York |année=2005 |pages totales= |passage=115-27 |isbn=0-7167-1007-2}}</ref>. Le dioxygène restant après l'oxydation de la [[molécule d'eau]] est rejeté dans l'atmosphère. Le dioxygène est essentiel dans la [[respiration cellulaire]] chez tous les organismes [[aérobie]]s. Les [[mitochondrie]]s l'utilisent pour aider à la production d'ATP pendant le processus de [[phosphorylation oxydative]]. La réaction modélisant la [[respiration aérobie]] est globalement l'inverse de celle modélisant la photosynthèse et s'écrit de façon simplifiée<ref>{{Lien web |langue=fr |url=http://esamultimedia.esa.int/docs/edu/dvdlessons/lessonnotes/ESADVDLessonNotes_Francais.pdf |titre=Les ingrédients de la vie sur Terre et dans l'espace |éditeur=[[Agence spatiale européenne]] |page=3 |consulté le=28 juin 2013}}</ref> : |
||
::{{chem|C|6|H|12|O|6}} + 6 {{chem|O|2}} → 6 {{chem|C||O|2}} + 6 {{chem|H|2|O}} + {{Unité/2|2880|kJ||mol|-1}}. |
::{{chem|C|6|H|12|O|6}} + 6 {{chem|O|2}} → 6 {{chem|C||O|2}} + 6 {{chem|H|2|O}} + {{Unité/2|2880|kJ||mol|-1}}. |
||
Version du 9 août 2015 à 01:16
| Dioxygène | |

| |
| Identification | |
|---|---|
| Nom UICPA | dioxygène |
| Synonymes |
oxygène moléculaire |
| No CAS | |
| No ECHA | 100.029.051 |
| No CE | 231-956-9 |
| Code ATC | V03 |
| PubChem | |
| No E | E948 |
| SMILES | |
| InChI | |
| Apparence | gaz incolore à température ambiante ; gaz liquéfié : liquide incolore à bleu[1] |
| Propriétés chimiques | |
| Formule | O2 [Isomères] |
| Masse molaire[2] | 31,998 8 ± 0,000 6 g/mol O 100 %, |
| Diamètre moléculaire | 0,292 nm |
| Propriétés physiques | |
| T° fusion | −219 °C[3] |
| T° ébullition | −183 °C[3] |
| Solubilité | dans l'eau à 20 °C : 3,1 ml/100 ml[1], 14,6 mg·l-1 (eau à 0 °C), |
| Masse volumique | |
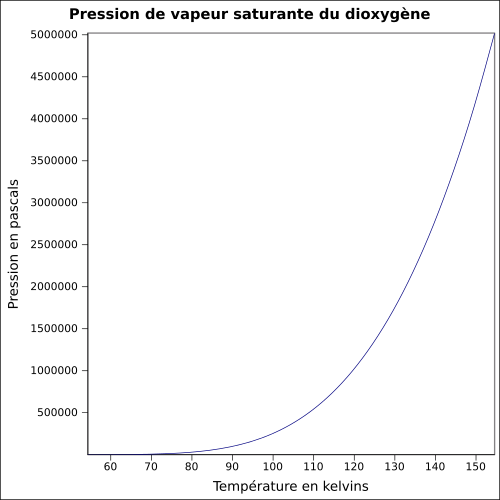
| Pression de vapeur saturante | à −118 °C : 5 080 kPa[1]
|
| Point critique | −118,67 °C 50,422 bar 0,636 1 kg·l-1 [3] |
| Point triple | −218,791 6 °C[5] 0,001 49 bar[3] |
| Vitesse du son | 330 m·s-1 (27 °C, 1 atm)[6] |
| Thermochimie | |
| ΔfusH° | 213 kJ/kg |
| ΔvapH° | 6,82 kJ·mol-1 (1 atm, −182,95 °C)[7] |
| Cp | |
| Propriétés électroniques | |
| 1re énergie d'ionisation | 12,069 7 ± 0,000 2 eV (gaz)[8] |
| Précautions | |
| SGH[9] | |
| H270 |
|
| SIMDUT[10] | |
  A, C, |
|
| NFPA 704 | |
| Transport | |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le dioxygène est une substance, dont la molécule est composée de deux atomes d'oxygène et est notée O2, qui est à l'état de gaz aux conditions normales de température et de pression. Incolore, inodore et insipide, il participe à des réactions d'oxydoréduction, essentiellement la combustion, la corrosion et la respiration.
Il est souvent appelé « oxygène » dans le langage courant mais cette appellation est ambiguë parce que ce terme peut désigner à la fois l'atome d'oxygène ou la molécule d'oxygène (O2), quoique le contexte puisse aider à faire la différence. A contrario, les termes « oxygène moléculaire » et « molécule d'oxygène » sont très souvent utilisés par les chimistes (au moins autant que le terme "dioxygène"), que ce soit en anglais ou en français pour désigner la molécule O2, mais aucune autre. L'utilisation du terme « oxygène moléculaire » pour de l'ozone est une erreur grossière.
Le dioxygène a été découvert le 1er août 1774 par le chimiste anglais Joseph Priestley, et baptisé du nom d'« oxygène » par le chimiste français Antoine Lavoisier en 1778.
Il compose 20,95 % en volume et 23,2 % en masse de l'atmosphère terrestre et est un gaz indispensable à de nombreuses formes de vie, auxquelles il fournit le comburant nécessaire au fonctionnement des cellules (respiration cellulaire). Il n'est en revanche pas indispensable au fonctionnement de certaines bactéries dites anaérobies, et il est même mortel pour les bactéries anaérobies strictes. Dans l'environnement aquatique, le dioxygène dissous est une condition nécessaire à la vie de très nombreuses espèces[11].
Origine
De nombreuses hypothèses ont été avancées pour expliquer la teneur de l'air en dioxygène :
- la plus communément retenue est qu'il s'agit d'un gaz produit lors du fonctionnement des cyanobactéries, et plus généralement des végétaux chlorophylliens, extrayant le carbone du dioxyde de carbone et rejetant l'oxygène (sous forme de dioxygène) par le mécanisme de la photosynthèse ;
- une seconde concerne la décomposition, dans la haute atmosphère, de molécules d'eau en dioxygène et dihydrogène, sous l'effet des rayonnements solaire et cosmique.
Les deux phénomènes existants, la réalité peut être une combinaison des deux processus.
Cyanobactéries
Il y a 4 milliards d'années, la Terre était presque totalement recouverte d'océans et son atmosphère composée de méthane, d'ammoniac et de dioxyde de carbone. Les bactéries présentes dans l'océan utilisaient exclusivement la fermentation comme source d'énergie, puis des mutants firent leur apparition. Ils étaient capable d'utiliser la lumière solaire comme source d'énergie, le CO2 comme source de carbone et H2O ou H2S comme source d'hydrogène. Ce fut la première apparition de la photosynthèse. Ces organismes autotrophes, c'est-à-dire capables de créer leurs propres nutriments, se généralisèrent puis mutèrent créant ainsi les premières cyanobactéries il y a 3,2 milliards d'années. Celles-ci utilisaient l'eau comme source d'hydrogène et rejetaient de l'oxygène, un poison mortel pour toutes les autres bactéries anaérobies.
Les bactéries sont toujours en compétition pour leur développement mais le fait que les cyanobactéries soient capables de tuer les autres bactéries parce qu'elles libèrent de l'oxygène a été un tournant décisif. On pense que la prolifération des cyanobactéries dans les océans a permis de complètement modifier l'atmosphère. Dans le même temps, certaines bactéries ont commencé à muter pour pouvoir utiliser l'oxygène comme source d'énergie au lieu de la fermentation. Or, l'énergie chimique de la molécule d'oxygène est très largement supérieure à ce que l'on peut obtenir par fermentation.
À un certain moment, ces bactéries capables de créer de l'énergie à partir de l'oxygène ont été littéralement phagocytées par d'autres bactéries/organismes qui ne pouvaient pas le faire. On considère d'ailleurs que les mitochondries présentes dans toutes les cellules, sont des bactéries qui ont été phagocytées et qui permettent aux cellules d'utiliser l'oxygène comme source d'énergie. On peut d'ailleurs noter que les mitochondries ont leur propre ADN, toujours issu de l'ovule, donc de la mère.
Rôles biologiques
Photosynthèse et respiration
Dans la nature, l'oxygène à l'état libre est produit par photolyse de l'eau grâce à la photosynthèse. D'après certaines estimations, les algues vertes et les cyanobactéries présentes en milieu marin fournissent environ 70 % de l'oxygène à l'état libre produit sur Terre, le reste étant produit par les plantes terrestres[12]. D'autres estimations affirment que la contribution des océans à l'apport d'oxygène atmosphérique est plus importante, d'autres encore affirment le contraire, suggérant que les océans produisent environ 45 % de l'oxygène atmosphérique chaque année[13].
Une formule globale et simplifiée traduisant la photosynthèse s'écrit[14] :
- 6 CO2 + 6 H2O + photons → C6H12O6 + 6 O2
ou simplement :
- dioxyde de carbone + eau + lumière solaire → glucose + dioxygène.
L'évolution photolytique de l'oxygène se produit dans la thylakoïde des organismes photosynthétiques et requiert l'énergie de quatre photons. Beaucoup d'étapes sont complexes mais le résultat aboutit la formation d'un gradient électrochimique au travers de la thilakoïde qui est utilisé pour synthétiser l'adénosine triphosphate (ATP) via le processus de photophosphorylation[15]. Le dioxygène restant après l'oxydation de la molécule d'eau est rejeté dans l'atmosphère. Le dioxygène est essentiel dans la respiration cellulaire chez tous les organismes aérobies. Les mitochondries l'utilisent pour aider à la production d'ATP pendant le processus de phosphorylation oxydative. La réaction modélisant la respiration aérobie est globalement l'inverse de celle modélisant la photosynthèse et s'écrit de façon simplifiée[16] :
- C6H12O6 + 6 O2 → 6 CO2 + 6 H2O + 2 880 kJ·mol-1.
Chez les vertébrés, le dioxygène diffuse à travers les membranes des cellules dans les poumons et les globules rouges. L'hémoglobine se lie au dioxygène et provoque un changement de couleur de la protéine qui passe du rouge bleuté au rouge vif[17],[A 1]. D'autres animaux n'utilisent pas l'hémoglobine pour le transport du dioxygène : les mollusques et certains arthropodes utilisent l'hémocyanine tandis que les araignées et les homards utilisent l'hémérythrine[18]. Un litre de sang peut dissoudre 200 cm3 de dioxygène[18].
Les dérivés réactifs de l'oxygène, comme l'ion superoxyde O2- et le peroxyde d'hydrogène H2O2, sont des sous-produits toxiques du dioxygène utilisés par les organismes[18]. Toutefois, certaines parties du système immunitaire des organismes évolués produisent du peroxyde, du superoxyde et de l'oxygène singulet pour éliminer les micro-organismes envahisseurs[19]. Les dérivés réactifs de l'oxygène jouent également un rôle important dans la réponse hypersensitive des plantes contre les attaques pathogènes[15].
Un adulte au repos inhale entre 1,8 et 2,4 grammes d'oxygène par minute[20]. Cela équivaut à plus de six milliards de tonnes d'oxygène inhalées par l'humanité chaque année[A 2].
La respiration aérobie consiste à absorber le dioxygène nécessaire au catabolisme oxydatif et à l'apport d'énergie aux cellules. Les organismes ont une capacité limite d'absorption, appelée consommation maximale d'oxygène.
La consommation de dioxygène est un indice d'activité cellulaire. Cette remarque est à l'origine d'une caractérisation de la pollution biodégradable d'un échantillon d'eau, la demande biologique en oxygène.
Présence dans le corps
C'est dans le système respiratoire que la pression partielle du dioxygène à l'état libre dans le corps d'un vertébré vivant est la plus élevée, puis est plus faible dans les artères puis dans les tissus périphériques et davantage encore dans les veines. La pression partielle en dioxygène est la pression qu'aurait le dioxygène s'il occupait seul un volume donné[21].
| Unité | Pression du gaz dans les alvéoles pulmonaires |
Gaz du sang artériel | Gaz du sang dans les veines |
|---|---|---|---|
| kPa | |||
| mmHg |
Dans l'atmosphère terrestre
Le dioxygène était quasiment inexistant dans l'atmosphère terrestre avant que les archées et les bactéries ne se développent, probablement il y a environ 3,5 milliards d'années. L'oxygène à l'état libre apparaît pour la première fois en quantité significative durant le paléoprotérozoïque (il y a entre 2,5 et 1,6 milliard d'années environ). Pendant le premier milliard d'années, tout l'oxygène produit par ces organismes se combine à du fer dissout dans les océans pour former des gisements de fer rubané. Quand ces puits d'oxygène sont saturés, l'oxygène libre commence à être relargué des océans, il y a 2,7 milliards d'années. Sa concentration atteint 10 % de son niveau actuel il y a environ 1,7 milliard d'années[25].
La présence d'une grande quantité de dioxygène dissout dans les océans et dans l'atmosphère peut avoir conduit à l'extinction les organismes anaérobies qui vivent alors, au cours de la crise écologique nommée la Grande Oxydation il y a environ 2,4 milliards d'années. Toutefois, la respiration cellulaire utilisant le dioxygène permet aux organismes aérobies de produire beaucoup plus d'ATP que les organismes anaérobies, les aidant ainsi à dominer la biosphère terrestre[26].
Depuis le début du Cambrien il y a 540 millions d'années, la concentration d'oxygène dans l'atmosphère a évolué, représentant au fil du temps entre 15 % et 30 % de son volume[27]. Vers la fin du Carbonifère il y a environ 300 millions d'années, le taux de dioxygène atmosphérique atteint un maximum : il représente alors 35 % du volume de l'atmosphère[27] ce qui pourrait avoir contribué à la grande taille des insectes et des amphibiens de l'époque[28]. Cette culmination de sa proportion dans l'atmosphère terrestre à cette époque est due à l'expansion massive des forêts de fougères géantes sur la Pangée, et à l'enfouissement progressif des produits organiques qui sont devenus les gisements de charbon[27]. Les activités humaines, y compris la combustion de 7 milliards de tonnes de combustibles fossiles chaque année ont un très faible impact sur la quantité d'oxygène libre dans l'atmosphère[18]. Au rythme actuel de la photosynthèse, il faudrait environ 2 000 ans pour produire la totalité du dioxygène présent aujourd'hui dans l'atmosphère[29].
Structure
Structure géométrique
La molécule est diatomique et la distance moyenne entre les deux atomes est 120,74 pm dans son état fondamental.
Dans ses deux premiers états excités (voir la partie spectroscopie ci-dessous), cette distance augmente à 121,55 pm dans le premier état et à 122,77 pm dans le deuxième.
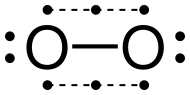
Représentation de Lewis
La représentation courante de Lewis du dioxygène, afin que ses deux atomes respectent la règle de l'octet, est une liaison double, chaque atome portant en outre deux doublets d'électrons non partagés. Cependant, cette structure ne rend pas compte du paramagnétisme de cette molécule. Il est possible de proposer un schéma de Lewis qui respecte cette observation expérimentale avec une liaison simple (et non une liaison double) et un électron célibataire par atome d'oxygène.
La représentation peu classique, avec une simple liaison, présente l'inconvénient de ne pas rendre compte de la courte distance de liaison (d = 120,74 pm), bien plus courte qu'une liaison simple O-O comme dans le peroxyde d'hydrogène H-O-O-H pour lequel la longueur de liaison est 145,7 pm. Cela explique en particulier pourquoi, dans la pratique, cette structure n'est utilisée qu'à titre pédagogique, pour mettre l'accent sur le caractère diradicalaire de la molécule. Une description plus performante est obtenue avec les orbitales moléculaires.
Diagramme d'orbitales moléculaires
Dans le cadre théorique des orbitales moléculaires (méthode CLOA), l'interaction entre deux atomes d'oxygène pour former une molécule se traduit par le diagramme ci-contre.


Les deux orbitales 2s des deux atomes d'oxygène, initialement de même énergie, subissent une dégénérescence, formant une orbitale σ2S liante et une orbitale σ*2S antiliante, toutes deux complètement occupées, ne résultant en aucune liaison entre les deux atomes. Les six orbitales 2p des deux atomes subissent elles aussi une dégénérescence, formant trois orbitale σ2px, σ2py, et σ2pz liantes et trois orbitale σ*2px, σ*2py, et σ*2pz antiliantes. Les huit (2*4) électrons 2p se répartissent selon :
- six électrons occupent les trois orbitales liantes de basse énergie ;
- les deux électrons restant occupent chacun une orbitale antiliante.
Cette combinaison d'orbitales 2p résulte donc en trois orbitales moléculaires liantes et une antiliante, soit une indice de liaison de 2. La répartition des deux électrons sur les deux orbitales antiliante explique aussi le caractère diradicalaire du dioxygène. Cette propriété d'être radicalaire alors que le nombre d'électrons de la molécules est pair est unique parmi les molécules diatomiques. Cette répartition explique aussi le caractère paramagnétique du dioxygène, ce que ne permet pas de présager sa représentation de Lewis « classique ».
Ce statut d'état triplet confère à la molécule des propriétés magnétiques (voir ci-dessous) et peut être rendu responsable de son inertie chimique à température ambiante. En effet, la réaction de O2 avec une autre molécule (H2, molécules organiques) qui est presque toujours dans un état singulet pour former une molécule en état singulet se déroule sans la conservation du spin total ; c'est la cause d'une grande lenteur des réactions chimiques impliquant le dioxygène à température et pression ordinaire.
Spectroscopie
Les deux premiers niveaux excités du dioxygène sont deux états singulets à 15 800 cm-1 (94,72 kJ.mol-1) et 21 100 cm-1 (157,85 kJ.mol-1) (voir diagramme). Ces transitions sont interdites de spin, ce qui conduit à ce que le dioxygène soit incolore. C'est le cas en phase gazeuse, la couleur bleue de l'atmosphère étant due à la diffusion Rayleigh[30].
La couleur bleue à l'état liquide (voir ci-dessous) résulte de l'absorption de deux photons à 7 918 cm-1 sur une association de deux molécules de dioxygène (dimère O4).
Magnétisme
Le dioxygène est paramagnétique. Cette propriété a été observée par Faraday dès 1848[30]. Le diagramme d'orbitale moléculaire du dioxygène tracé par la méthode CLOA en rend compte. La configuration électronique contient en effet deux électrons célibataires sur les deux orbitales Π* (état triplet).
En résonance magnétique nucléaire (RMN), pour des mesures fines, il est important de dégazer l'échantillon pour éliminer l'oxygène moléculaire qui est paramagnétique et va gêner la détection en provoquant un élargissement des pics. Ce dégazage est, en général, accompli en faisant buller un gaz inerte (azote ou argon) dans la solution pour remplacer les gaz dissous par ce gaz inerte et non paramagnétique.
Production
Production industrielle
Toutefois, les deux phénomènes sont totalement indépendants : le bleu du ciel est dû à la diffusion Rayleigh, celui du dioxygène liquide vient de l'absorption de la lumière rouge.
Le dioxygène est obtenu de manière industrielle principalement (à 95 %) par séparation cryogénique des composés de l'air, c'est-à-dire par une liquéfaction de l'air suivie d'une distillation fractionnée.
Les températures critiques du diazote N2 (Tc = −146,9 °C) et du dioxygène O2 (Tc = −118,4 °C) ne permettent pas la liquéfaction de l'air par simple compression. L'air doit donc être comprimé entre 5 et 7 bar, puis filtré, séché, décarbonaté par adsorption sur tamis moléculaire et enfin refroidi par échange thermique entre le gaz entrant et les gaz liquéfiés. Les pertes frigorifiques sont compensées par une détente de 5 à 10 % du débit gazeux traité, dans une turbine dont le travail extérieur est récupérable.
La distillation, dans le procédé le plus utilisé, est effectuée dans une double colonne qui permet d'obtenir, en continu, des gaz purs. La première colonne (moyenne pression, 5 bar) réalise une première séparation de l'air en diazote gazeux pur (à 99,999 %) au sommet et un liquide riche en dioxygène (environ 40 %), à la base. Ce liquide est alors envoyé à mi-hauteur de la deuxième colonne de distillation (basse pression, 1,3 bar). Le dioxygène O2 entre 99,5 % et 99,7 % est récupéré à la base de cette deuxième colonne. Il contient moins de 1 ppm de diazote, la principale impureté est l'argon.
Les colonnes de distillation ont entre 1 et 6 m de diamètre, et mesurent de 15 à 25 m de hauteur. Elles sont en acier inoxydable ou en aluminium et comportent une centaine de plateaux. L'isolation thermique est réalisée avec de la perlite (sable de silice expansé). Le maintien en température des colonnes ne consomme que 6 à 7 % de l'énergie totale dépensée.
La consommation en énergie est de 0,4 kWh m−3 de dioxygène gazeux, soit de 50 à 60 % du prix de revient.
Environ 5 % du dioxygène industriel est produit par un autre procédé, non cryogénique, appelé VPSA (Vacuum-pressure swing adsorption) ou adsorption par alternance de pression et de vide.
L'air ambiant est séché et épuré par filtration, puis passe dans une colonne de zéolithes qui adsorbent plus rapidement le diazote N2 que le dioxygène O2. Les zéolites peuvent fixer 10 litres de diazote par kilogramme. Lorsqu'elles sont saturées, l'air est envoyé sur une seconde colonne, pendant que le diazote de la première colonne désorbe sous vide. La pureté du dioxygène obtenu ainsi par élimination du diazote de l'air peut atteindre 90 à 95 %. Ce dioxygène contient encore 4,5 % d'argon qui, comme le dioxygène, n'est pas adsorbé. La consommation d'énergie est de 0,4 à 0,5 kWh m−3 de dioxygène. Cette méthode est de plus en plus employée dans les procédés industriels dont les besoins sont inférieurs à 100 tonnes/jour, ainsi que dans les respirateurs utilisés à domicile. Voir aussi Concentrateur d'oxygène.
L'oxygène produit est transporté :
- sous forme liquide ou gazeuse par des canalisations appelées oxyducs ou oxygénoducs ;
- sous forme gazeuse comprimée dans des bouteilles ou réservoirs en acier à 200 bar ;
- sous forme liquide, en camions-citernes.
En 1995, huit compagnies dans le monde fabriquaient la quasi-totalité de l'oxygène industriel :
- Air liquide (France) : 17 % ;
- BOC (Royaume-Uni) : 14 % (racheté par Linde en 2006) ;
- Praxair (États-Unis) : 14 % ;
- Air Products (États-Unis) : 8 % ;
- Nippon Sanso (Japon) : 7 % ;
- AGA (Suède) : 7 % (racheté par Linde en 2000) ;
- Messer (Allemagne) : 6 % ;
- Linde (Allemagne) : 6 %.
Les principaux pays producteurs en 1996, étaient :
- États-Unis : 27 millions de tonnes ;
- Japon : 12,7 millions de tonnes ;
- France : 3,23 millions de tonnes.
Dans le monde, la production totale était de l'ordre de 100 millions de tonnes en 1996, soit 1⁄10 millionième du dioxygène de l'atmosphère.
Au laboratoire
Le dioxygène a longtemps été préparé en petite quantité, au laboratoire, par réaction de l'oxylithe Na2O2 avec l'eau.
Il peut être préparé par électrolyse de l'eau pour des démonstrations pédagogiques, mais cette technique est lente et couteuse en énergie.
Il peut également être produit par la décomposition catalytique de l'eau oxygénée en présence d'oxyde de manganèse(IV) MnO2.
Réactivité
Le dioxygène est thermodynamiquement très réactif, et la plupart de ses réactions sont fortement exothermiques. Cette grande réactivité n'a généralement pas lieu à température ambiante. Les raisons cinétiques ont été détaillées ci-dessus.
Avec les corps simples
Peu de corps simples ne se combinent pas directement avec le dioxygène : le tungstène W, le platine Pt, l'or Au et les gaz nobles. Il faut noter que des composés oxygénés de gaz nobles existent cependant (XeO3), mais ils n'ont jamais pu être obtenus par action directe avec O2.
Le fait que les oxydes existent pour quasiment tous les éléments a largement aidé Mendeleïev à classer les éléments chimiques (1869). Par ailleurs, le fait que certains éléments chimiques possèdent plusieurs oxydes distincts (par exemple l'azote) a été à l'origine de l'émergence la notion d'atome par Dalton (1800).
Les ions de O2
De nombreux ions de O2 sont connus :
- O2+, dans de rares composés ;
- O2-, anion superoxyde, fréquent dans les systèmes biologiques pour lesquels l'oxydoréduction est souvent monoélectronique ; c'est une entité peu stable ;
- O22-, anion peroxyde, fréquent dans les peroxydes métalliques comme le peroxyde de baryum BaO2 ; l'oxygène y a le même degré d'oxydation que dans le peroxyde d'hydrogène H2O2.
Réaction du dioxygène singulet 1O2
Le dioxygène singulet est produit par irradiation lumineuse de dioxygène triplet (son état fondamental) 3O2 avec un photosensibilisateur. Il faut pour cela que l'état excité de ce dernier soit supérieur à 94,7 kJ·mol-1 (voir ci-dessus la partie spectroscopie).
- 3O2 + 1Sensibilisateur — hν → 1O2 + 3Sensibilisateur.
Le dioxygène singulet peut aussi être produit chimiquement, par exemple en solution alcoolique, avec un mélange d'eau oxygénée et d'eau de Javel[31] :
L'oxygène singulet est très réactif, tant chimiquement que biologiquement.
Utilisations
Le dioxygène, dans l'air, est utilisé pour les combustions (chauffage, transport)[32].
Séparé du diazote, son principal usage est la sidérurgie. Le fer, en sortie des hauts fourneaux, est sous forme de carbure Fe3C, inutilisable car contenant plus de 4 % en masse de carbone. Ce carbone est brulé par injection de dioxygène directement dans le fer fondu. C'est le principe des convertisseurs. Il faut 60 m3 CNTP de O2 par tonne de fer. La consommation d'un site sidérurgique se chiffre en milliers de tonnes de O2 par jour.
La pétrochimie est également une importante consommatrice quand il est question de produire de l'oxyde d'éthylène, de l'oxyde de propylène, du chlorure de vinyle par oxychloration, dans le raffinage des produits pétroliers, pour régénérer des catalyseurs, etc.
D'autres procédés nécessitent également de gros tonnages de dioxygène :
- la synthèse du dioxyde de titane par le procédé au dichlore ;
- le blanchiment de la pâte à papier, ce qui limite la consommation en dichlore Cl2 qui reste l'agent de blanchiment principal ;
- le retraitement de certains déchets chimiques par exemple, les déchets soufrés issus de la production de méthacrylate de méthyle, ce qui conduit à la récupération de H2SO4.
Les autres usages ponctuels sont par exemple :
- la production de flammes à haute température, comme celle du chalumeau oxhydrique ;
- comme gaz médical :
- oxygénothérapie normobare (à pression atmosphérique) : dans l'assistance respiratoire de personnes ayant des difficultés respiratoires (maladies telles que l'asthme ou l'insuffisance respiratoire chronique, ou lors d'une anesthésie), pour la ventilation artificielle (arrêt de la respiration) ;
- oxygénothérapie hyperbare (à haute pression) : pour le traitement de certaines intoxications au gaz (notamment au monoxyde de carbone), des accidents de décompression en plongée ou de certaines brûlures, de certaines pathologies artéritiques.
-
Schéma d'un convertisseur avec l'apport de dioxygène directement dans le métal fondu.
-
Convertisseur en fonctionnement ; la réaction du fer fondu avec le dioxygène produit des gerbes de lumière.
-
Dioxygène médical en bouteille.
Notes
- Le dioxyde de carbone est libéré d'une autre partie de l'hémoglobine via l'effet Bohr.
- (1,8 gramme/minute par personne)×(60 minutes/heure)×(24 heures/jour)×(365 jours/an)×(6,6 milliards de personnes)÷(1 000 000 grammes/tonne)=6,24 milliards de tonnes.
Références
- OXYGENE et OXYGENE (LIQUEFIED), Fiches internationales de sécurité chimique
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Entrée du numéro CAS « 7782-44-7 » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 28 janvier 2009 (JavaScript nécessaire)
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, USA, McGraw-Hill, , 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50
- Procès-verbaux du Comité international des poids et mesures, 78e session, 1989, p. T1-T21 (et p. T23-T42, version anglaise).
- (en) W. M. Haynes, Handbook of chemistry and physics, CRC, 2010-2011, 91e éd., 2610 p. (ISBN 9781439820773), p. 14-40
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press Inc, , 90e éd., 2804 p., Relié (ISBN 978-1-420-09084-0)
- (en) David R. Lide, Handbook of chemistry and physics, CRC, , 89e éd., 2736 p. (ISBN 9781420066791), p. 10-205
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE no 1272/2008 (16 décembre 2008)
- « Oxygène » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- (en) University of Wisconsin. (2006), Dissolved oxygen:aquatic life depends on it, Water Action Volunteers-Volunteer Stream Monitoring Factsheet Series. Disponible à http://watermonitoring.uwex.edu/pdf/level1/FactSeries-DissolvedOxygen.pdf (consulté le 25 février 2010)
- (en) William Fenical, « Marine Plants: A Unique and Unexplored Resource », dans Plants: the potentials for extracting protein, medicines, and other useful chemicals (workshop proceedings), DIANE Publishing, (ISBN 1-4289-2397-7, lire en ligne), p. 147
- (en) J. C. G. Walker, The oxygen cycle in the natural environment and the biogeochemical cycles, Springer-Verlag,
- (en) Theodore L. Brown et Burslen LeMay, Chemistry: The Central Science, Prentice Hall/Pearson Education, (ISBN 0-13-048450-4), p. 958
- (en) Peter H. Raven, Ray F. Evert et Susan E. Eichhorn, Biology of Plants, 7th Edition, New York, W.H. Freeman and Company Publishers, (ISBN 0-7167-1007-2), p. 115-27
- « Les ingrédients de la vie sur Terre et dans l'espace », Agence spatiale européenne (consulté le ), p. 3
- (en) Albert Stwertka, Guide to the Elements, Oxford University Press, (ISBN 0-19-508083-1), p. 48-49
- (en) John Emsley, Nature's Building Blocks: An A-Z Guide to the Elements, Oxford, Angleterre, Oxford University Press, (ISBN 0-19-850340-7), p. 297-304
- Charles A. Janeway et Paul Travers, Immunobiologie : Le système immunitaire fondamental et pathologique, De Boeck, , 784 p. (ISBN 2-7445-0150-6), p. 41
- (en) « Flow restrictor for measuring respiratory parameters », Patenstorm (consulté le ) : « For humans, the normal volume is 6–8 liters per minute. »
- (en) Charles Henrickson, Chemistry, Cliffs Notes, (ISBN 0-7645-7419-1)
- Résultat obtenu à partir de la valeur en mmHg en utilisant pour la conversion 0,133 322 kPa/mmHg
- (en) « Normal Reference Range Table », The University of Texas Southwestern Medical Center, Dallas (consulté le )
- (en) « The Medical Education Division of the Brookside Associates → ABG (Arterial Blood Gas) » (consulté le )
- (en) Neil A. Campbell et Jane B. Reece, Biology, 7th Edition, San Francisco, Pearson – Benjamin Cummings, (ISBN 0-8053-7171-0), p. 522-23
- (en) Scott Freeman, Biological Science, 2nd, Upper Saddle River, NJ, Pearson – Prentice Hall, (ISBN 0-13-140941-7), p. 214, 586
- (en) Robert A. Berner, « Atmospheric oxygen over Phanerozoic time », Proceedings of the National Academy of Sciences of the USA, vol. 96, no 20, , p. 10955–57 (PMID 10500106, DOI 10.1073/pnas.96.20.10955, lire en ligne)
- DOI 10.1111/j.1472-4669.2009.00188.x
Cette citation sera générée dans quelques minutes. Vous pouvez sauter la queue ou la compléter à la main - (en) Malcolm Dole, « The Natural History of Oxygen », The Journal of General Physiology, vol. 49, no 1, , p. 5-27 (PMID 5859927, DOI 10.1085/jgp.49.1.5, lire en ligne)
- Greenwood N.N. et Earnshaw A. (1997). Chemistry of the Elements. 2e éd., Elsevier, p. 606.
- (en) Greenwood N.N. et Earnshaw A. (1997). Chemistry of the Elements, 2e éd., Elsevier, p. 615.
- Vigne J.-L., Données industrielles.
Voir aussi
Articles connexes
Bibliographie
- Davis JC (1975) Waterborne dissolved oxygen requirements and criteria with particular emphasis on the Canadian environment. in : Associate Committee on Scientific Criteria for Quality. National