« Argon » : différence entre les versions
Rédaction. |
m →Propriétés notables : style |
||
| Ligne 51 : | Ligne 51 : | ||
}}</ref>. |
}}</ref>. |
||
Le fluorohydrure d'argon est le seul composé connu |
Le fluorohydrure d'argon est le seul composé connu de l'argon qui soit neutre et stable à l'[[état fondamental]]. L'argon peut également former des [[clathrate]]s dans l'[[eau]] lorsque ses atomes sont emprisonnés dans le réseau tridimensionnel formé par la [[glace]]<ref name="10.1088/1742-6596/29/1/001"> |
||
{{Article |
{{Article |
||
| langue = en |
| langue = en |
||
Version du 13 juin 2020 à 07:36
| Argon | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Argon solide et liquide. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Position dans le tableau périodique | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Symbole | Ar | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nom | Argon | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Numéro atomique | 18 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Groupe | 18 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Période | 3e période | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bloc | Bloc p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Famille d'éléments | Gaz noble | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuration électronique | [Ne] 3s2 3p6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Électrons par niveau d’énergie | 2, 8, 8 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés atomiques de l'élément | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masse atomique | 39,948 ± 0,001 u | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon atomique (calc) | (71 pm) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon de covalence | 106 ± 10 pm[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon de van der Waals | 188 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| État d’oxydation | 0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxyde | inconnu | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Énergies d’ionisation[2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1re : 15,759 610 eV | 2e : 27,629 66 eV | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3e : 40,74 eV | 4e : 59,81 eV | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5e : 75,02 eV | 6e : 91,009 eV | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 7e : 124,323 eV | 8e : 143,460 eV | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 9e : 422,45 eV | 10e : 478,69 eV | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 11e : 538,96 eV | 12e : 618,26 eV | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 13e : 686,10 eV | 14e : 755,74 eV | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 15e : 854,77 eV | 16e : 918,03 eV | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 17e : 4 120,885 7 eV | 18e : 4 426,229 6 eV | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotopes les plus stables | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés physiques du corps simple | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| État ordinaire | Gaz (non magnétique) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
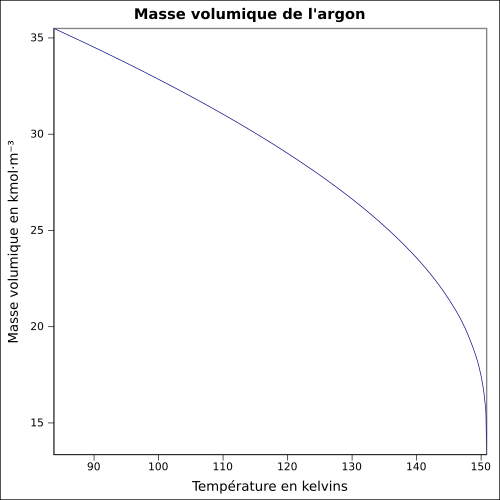
| Masse volumique | 1,783 7 g·L-1 (0 °C, 1 atm)[3] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Système cristallin | Cubique à faces centrées | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Couleur | incolore | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point de fusion | −189,36 °C[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point d’ébullition | −185,85 °C[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Énergie de fusion | 1,188 kJ·mol-1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Énergie de vaporisation | 6,43 kJ·mol-1 (1 atm, −185,85 °C)[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Température critique | −122,3 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point triple | −189,344 2 °C, 688,9 hPa[5],[6] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Volume molaire | 22,414×10-3 m3·mol-1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pression de vapeur | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vitesse du son | 319 m·s-1 à 20 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chaleur massique | 520 J·kg-1·K-1
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivité thermique | 0,017 72 W·m-1·K-1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Divers | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| No CAS | [7] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| No ECHA | 100.028.315 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| No CE | 231-147-0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| No E | E938 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Précautions | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SGH[8] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| H280 et P403 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SIMDUT[9] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 A, |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Transport[8] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Unités du SI & CNTP, sauf indication contraire. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| modifier |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
L'argon est l'élément chimique de numéro atomique 18 et de symbole Ar. Il appartient au groupe 18 du tableau périodique et fait partie de la famille des gaz nobles, également appelés « gaz rares », qui regroupe également l'hélium, le néon, le krypton, le xénon et le radon. L'argon est le 3e constituant le plus abondant de l'atmosphère terrestre, avec une fraction massique de 1,288 %, correspondant à une fraction volumique de 0,934 % (soit 9 340 ppm), et est le gaz noble le plus abondant de l'écorce terrestre, dont il représente 1,5 ppm. L'argon de l'atmosphère terrestre est presque entièrement constitué d'argon 40, nucléide radiogénique provenant de la désintégration du potassium 40, tandis que l'argon observé dans l'univers est essentiellement constitué d'argon 36, produit par nucléosynthèse stellaire dans les supernovae.
Le nom argon provient du grec ancien ἀργόν, signifiant « oisif », « paresseux », en référence au fait que cet élément est chimiquement inerte. Sa configuration électronique présente une couche de valence saturée à l'origine de sa stabilité et de la quasi impossibilité d'établir des liaisons covalentes. La température de 83,805 8 K de son point triple est l'un des points de référence de l'Échelle internationale de température de 1990 (ITS-90).
L'argon est produit industriellement par distillation fractionnée d'air liquiéfié. Il est utilisé essentiellement comme atmosphère inerte pour le soudage et divers procédés industriels à haute température faisant intervenir des substances réactives. On utilise ainsi une atmosphère d'argon dans les fours à arc électrique au graphite pour éviter la combustion de ce dernier. On emploie également l'argon dans l'éclairage par lampes à incandescence, tubes fluorescents et tubes à gaz. Il permet de réaliser des lasers à gaz bleu-vert.
Propriétés notables

L'argon est incolore, inodore, ininflammable et non toxique aussi bien à l'état gazeux que liquide ou solde. Sa solubilité dans l'eau est à peu près comparable à celle de l'oxygène et vaut 2,5 fois celle de l'azote. Il est chimiquement inerte dans à peu près toutes les conditions et ne forme aucun composé chimique confirmé à température ambiante.
L'argon est cependant susceptible de former des composés chimiques dans certaines conditions extrêmes hors équilibre. Le fluorohydrure d'argon HArF a ainsi été obtenu par photolyse ultraviolette de fluorure d'hydrogène HF dans une matrice cryogénique d'iodure de césium CsI et d'argon Ar[10] ; stable en-dessous de 27 K (−246,15 °C), il a été identifié par spectroscopie infrarouge[11].
Le fluorohydrure d'argon est le seul composé connu de l'argon qui soit neutre et stable à l'état fondamental. L'argon peut également former des clathrates dans l'eau lorsque ses atomes sont emprisonnés dans le réseau tridimensionnel formé par la glace[12]. Il existe également des ions contenant de l'argon, comme ArH+, et des exciplexes, tels qu'ArF. Divers composés présentant des liaisons Ar–C et Ar–Si stables ont été prédits par simulation numérique mais n'ont pas été synthétisés en laboratoire[13].
Isotopes
Les principaux isotopes d'argon présents dans l'écorce terrestre sont l'argon 40 (40Ar) pour 99,6 %, l'argon 36 (36Ar) pour 0,34 % et l'argon 38 (38Ar) pour 0,06 %. Le potassium 40 (40K) se désintègre spontanément à raison de 11,2 % en argon 40 par capture électronique ou émission de positron et à raison de 88,8 % en calcium 40 (40Ca) par désintégration β- avec une période radioactive (demi-vie) de 1,25 milliards d'années. Ces Cette durée et le rapport entre les sous-produits formés permettent de déterminer l'âge de roches par la méthode de la datation au potassium-argon[14].
Dans l'atmosphère terrestre, l'argon 39 est produit essentiellement par l'interaction du rayonnement cosmique sur l'argon 40 par capture neutronique suivie par une double émission de neutron[15]. Dans le sous-sol, il peut être également produit à partir de potassium 39 par capture neutronique suivie par une émission de proton.
L'argon 37 est produit lors des essais nucléaires souterrains à partir de calcium 40 par capture neutronique suivie d'une radioactivité α ; il présente une période radioactive de 35 jours[16].
L'argon est remarquable parce que sa composition isotopique varie sensiblement selon les régions du Système solaire. Lorsque la source principale d'argon est la désintégration radioactive du potassium 40 des roches, l'argon 40 sera l'isotope majoritaire, comme sur les planètes telluriques retenant une atmosphère : Vénus, la Terre et Mars. En revanche, l'argon formé directement par nucléosynthèse stellaire est essentiellement constitué d'argon 36 produit par réaction alpha. Ainsi, l'argon du Soleil est constitué à 84,6 % d'argon 36 selon les mesures du vent solaire[17]. Il en est de même dans les planètes géantes, où l'abondance relative des isotopes 36Ar : 38Ar : 40Ar vaut 8400 : 1600 : 1[18].
Outre l'atmosphère terrestre, qui présente une fraction volumique de 0,934 % d'argon, soit 9 340 ppm, l'atmosphère de Mercure en contient 0,07 ppm, celle de Vénus en contient 70 ppm, et celle de Mars en contient 1,93 %, soit 19 300 ppm[19].
La prédominance de l'argon 40 radiogénique dans l'atmosphère terrestre est responsable du fait que la masse atomique de l'argon terrestre est supérieure à celle de l'élément chimique suivant, le potassium. Ceci semblait paradoxal lors de la découverte de l'argon en 1894 car Dmitri Mendeleïev avait rangé son tableau périodique des éléments par ordre de masse atomique croissante, mais l'inertie chimique de l'argon implique qu'il soit placé avant le potassium, qui est un métal alcalin très réactif. Ce problème fut résolu par Henry Moseley, qui démontra en 1913 que le tableau périodique devait être rangé par ordre de numéro atomique croissant, et non par masse atomique croissante.
L'abondance atmosphérique relative de l'argon par rapport aux autres gaz nobles — 9 340 ppm d'argon, contre 5,24 ppm d'hélium, 18,18 ppm de néon, 1,14 ppm de krypton et 0,087 ppm de xénon — peut aussi être attribuée à l'argon 40 radiogénique : l'argon 36 présente en effet une abondance de seulement 31,5 ppm (= 9 340 ppm x 0,337 %), comparable à celle du néon (18,18 ppm).
Histoire et étymologie
Le mot argon dérive du grec ancien ἀργός / argós (« oisif », « paresseux », « stérile »), formé du préfixe grec privatif ἀ et du mot ἔργον / ergon (« travail »), cette étymologie évoquant le caractère inerte de l'élément[20].
La présence dans l’air de l’argon fut suspectée par Henry Cavendish dès 1785 mais sa découverte par Lord Rayleigh et Sir William Ramsay attendit 1894. Ces deux scientifiques firent à la Royal Society la communication officielle de leur découverte le [21].
Ils furent mis sur la piste par la différence de densité entre l’azote produit chimiquement et celui extrait de l’air par élimination de l’oxygène. La distillation fractionnée de l’air liquide leur permit d’en produire une quantité notable en 1898 et par la même occasion d’isoler le néon et le xénon.
L’argon a aussi été rencontré en 1882 aux travers de recherches indépendamment menées par H. F. Newall et W. N. Hartley.
Le symbole de l’argon n'est Ar que depuis 1957, auparavant c'était simplement A.
La première molécule impliquant l’argon (HArF) a été synthétisée en 2000.
Composés
L'argon possède une couche de valence complète avec sous-couches s et p remplies. Il est alors très stable et très résistant à se lier à d'autres éléments. Avant 1962, tous les gaz nobles y compris l'argon étaient considérés chimiquement inertes et incapables de former le moindre composé. Cependant des composés de gaz nobles plus lourds (krypton et xénon) ont été synthétisés depuis.
En 2000, le premier composé de l'argon fut synthétisé par des chercheurs à l'Université de Helsinki (Finlande). Lors de l'irradiation par la lumière ultraviolette d'argon congelé contenant une petite quantité du fluorure d'hydrogène (HF), une petite quantité de fluorohydrure d'argon (HArF) fut formée. Il est stable aux températures inférieures à 40 K (-233 °C). En 2010, le cation métastable ArCF22+ fut observé.
Applications
L'argon est, entre autres, utilisé :
- pour la conservation de la viande dans l'industrie agro-alimentaire ;
- comme gaz inerte dans les lampes à incandescence même aux températures élevées (dans les cas où le diazote ne convient pas comme gaz semi-inerte) ;
- comme gaz inerte de protection pour le soudage (TIG ou MIG-MAG, notamment) et le découpage (Ar+O2) ;
- comme gaz inerte en chimie fine pour réaliser des manipulations en l’absence d’oxygène ;
- comme gaz inerte dans la lame d’air des vitrages isolants à faible émission[22] ;
- comme gaz inerte dans les réservoirs d’extinction d’incendie (allié à 50 % d’azote) ;
- comme atmosphère protectrice pour la fabrication de cristaux de silicium et de germanium ultra-pur pour l'industrie électronique ;
- en plongée sous-marine pour gonfler la combinaison étanche, à cause de ses propriétés d’isolant thermique non-réactif ;
- en médecine pour l'électrocoagulation par voie endoscopique de lésions responsables de saignement digestif[23].
L’argon 39 a été employé notamment pour dater des eaux souterraines et des échantillons de glace en Antarctique[15].
En récupération, lors de la cuisson d'écume d'aluminium dans des fours à plasma, l'argon stabilise la réaction d'inflammabilité de l'aluminium qui tend à s'auto-allumer.
L'argon est produit industriellement par distillation fractionnée d'air liquide dans un réacteur de séparation d'air cryogénique. C'est un procédé qui permet de séparer l'azote liquide, qui bout à 77,3 K, de l'argon qui bout à 87,3 K et de l'oxygène liquide qui bout à 90,2 K. Environ 700 000 tonnes d'argon sont produites dans le monde entier chaque année[24].
40Ar, l'isotope le plus abondant de l'argon, est produit par la décroissance radioactive du 40K qui a une demi-vie de 1,25 × 109 ans par capture d'électrons ou émission de positrons. Grâce à cela, il est utilisé dans les datations potassium-argon et argon-argon pour déterminer l'âge des roches.
L'argon est utilisé dans beaucoup de procédés industriels à haute température, où des substances ordinairement non réactives le deviennent. Par exemple, une atmosphère d'argon est utilisée dans les fours électriques graphites pour empêcher le graphite de brûler.
Pour certains de ces procédés, la présence d'azote ou d'oxygène gazeux peut endommager le matériau. L'argon est utilisé dans de nombreux types de soudure à arc. Une atmosphère d'argon est également utilisée pour grossir les cristaux de sillicium et de germanium.
L'argon est utilisé dans l'industrie avicole pour asphyxier les animaux, soit pour un abattage de masse après l'apparition d'une maladie, soit comme moyen d'abattage plus humain que l'électronarcose[réf. souhaitée]. La relativement grande densité de l'argon le fait rester près du sol lors du gazage. Sa nature non réactive le rend compatible avec les produits alimentaires[citation nécessaire][25].
L'argon est parfois utilisé pour éteindre les incendies là où il faut éviter d'endommager les équipements.
Dangers
Tout comme l’hélium, l’argon n’est pas dangereux à faible concentration. Toutefois, une inhalation d’une grande quantité comporte des risques d’asphyxie par privation d’oxygène (Risque d'anoxie) ; ceci peut se produire lors d'opérations de soudage dans un espace confiné.
Notes et références
- (en) Beatriz Cordero, Verónica Gómez, Ana E. Platero-Prats, Marc Revés, Jorge Echeverría, Eduard Cremades, Flavia Barragán et Santiago Alvarez, « Covalent radii revisited », Dalton Transactions, , p. 2832 - 2838 (DOI 10.1039/b801115j)
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, TF-CRC, , 87e éd. (ISBN 0849304873), p. 10-202
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press Inc, , 90e éd., 2804 p., Relié (ISBN 978-1-420-09084-0)
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, USA, McGraw-Hill, , 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50
- Procès-verbaux du Comité international des poids et mesures, 78e session, 1989, pp. T1-T21 (et pp. T23-T42, version anglaise).
- (en) William M. Haynes, CRC Handbook of Chemistry and Physics, CRC Press Inc, , 92e éd. (ISBN 1-4398-5511-0)
- Base de données Chemical Abstracts interrogée via SciFinder Web le 15 décembre 2009 (résultats de la recherche)
- Entrée du numéro CAS « 7440-37-1 » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 30 janvier 2009 (JavaScript nécessaire)
- « Argon » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- (en) Markku Räsänen, « Argon out of thin air », Nature Chemistry, vol. 6, no 1, , article no 82 (PMID 24345939, DOI 10.1038/nchem.1825, lire en ligne)
- (en) Leonid Khriachtchev, Mika Pettersson, Nino Runeberg, Jan Lundell et Markku Räsänen, « A stable argon compound », Nature, vol. 406, no 6798, , p. 874-876 (PMID 10972285, DOI 10.1038/35022551, Bibcode 2000Natur.406..874K, lire en ligne)
- (en) V. R. Belosludov, O. S. Subbotin, D. S. Krupskii, O. V. Prokuda, R. V. Belosludov et Y. Kawazoe, « Microscopic model of clathrate compounds », Journal of Physics: Conference Series, vol. 29, no 1, , p. 1-7 (DOI 10.1088/1742-6596/29/1/001, Bibcode 2006JPhCS..29....1B, lire en ligne)
- (en) Arik Cohen, Jan Lundell et R. Benny Gerber, « First compounds with argon–carbon and argon–silicon chemical bonds », Journal of Chemical Physics, vol. 119, no 13, , p. 6415-6417 (DOI 10.1063/1.1613631, Bibcode 2003JChPh.119.6415C, lire en ligne)
- (en) J. Emsley, Nature's Building Blocks, Oxford University Press, 2001, p. 44–45. (ISBN 978-0-19-960563-7)
- Étienne Roth (dir.), Bernard Poty (dir.), Robert Delmas et al. (préf. Jean Coulomb), Méthodes de datation par les phénomènes nucléaires naturels, Paris, Éditions Masson, coll. « Collection CEA », , 631 p. (ISBN 978-2-225-80674-2, BNF 34836710), chap. 17 (« Silicium 32 et argon 39 »)
- (en) The Science Case for 37Ar as a Monitor for Underground Nuclear Explosions, page 1, 2010
- (en) Katharina Lodders, « The Solar Argon Abundance », The Astrophysical Journal, vol. 674, no 1, , p. 607-611 (DOI 10.1086/524725, Bibcode 2008ApJ...674..607L, arXiv arXiv:0710.4523, lire en ligne)
- (en) A. G. W. Cameron, « Elemental and isotopic abundances of the volatile elements in the outer planets », Space Science Reviews, vol. 14, nos 3-4, , p. 392-400 (DOI 10.1007/BF00214750, Bibcode 1973SSRv...14..392C, lire en ligne)
- (en) Paul R. Mahaffy, Christopher R. Webster, Sushil K. Atreya, Heather Franz, Michael Wong, Pamela G. Conrad, Dan Harpold, John J. Jones, Laurie A. Leshin, Heidi Manning, Tobias Owen, Robert O. Pepin, Steven Squyres, Melissa Trainer, MSL Science Team, « Abundance and Isotopic Composition of Gases in the Martian Atmosphere from the Curiosity Rover », Science, vol. 341, no 6143, , p. 263-266 (PMID 23869014, DOI 10.1126/science.1237966, Bibcode 2013Sci...341..263M, lire en ligne)
- Paul Depovere, La classification périodique des éléments. La merveille fondamentale de l'Univers, De Boeck Supérieur, , p. 98.
- (en) John H. Holloway, Noble-gas chemistry, Methuen, , p. 6
- http://www.mes-portes-et-fenetres.fr/fenetres/les-differents-gaz-utilises-pour-vos-vitrages/
- (en) Jerome Canady, Kimberly Wiley et Biagio Ravo, « Argon plasma coagulation and the future applications for dual-mode endoscopic probes », Reviews in Gastroenterological Disorders, vol. 6, no 1, , p. 1-12 (ISSN 1533-001X, PMID 16520707, lire en ligne, consulté le ).
- « Periodic Table of Elements: Argon – Ar », Environmentalchemistry.com (consulté le )
- D. L. Fletcher, « Slaughter Technology », Symposium: Recent Advances in Poultry Slaughter Technology, (lire en ligne, consulté le )
Voir aussi
Articles connexes
Liens externes
- (en) « Technical data for Argon » (consulté le ), avec en sous-pages les données connues pour chaque isotope
- (en) Images de l'argon sous différentes formes
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
| 8 | 119 | 120 | * | ||||||||||||||||||||||||||||||
| * | 121 | 122 | 123 | 124 | 125 | 126 | 127 | 128 | 129 | 130 | 131 | 132 | 133 | 134 | 135 | 136 | 137 | 138 | 139 | 140 | 141 | 142 | |||||||||||
| Métaux alcalins | Métaux alcalino-terreux | Lanthanides | Métaux de transition | Métaux pauvres | Métalloïdes | Non-métaux | Halogènes | Gaz nobles | Éléments non classés |
| Actinides | |||||||||
| Superactinides |