« Cytosquelette » : différence entre les versions
m Révocation des modifications de 196.121.79.161 (retour à la dernière version de Goultard59): révocation vandalisme |
Réécriture de l'article. Clarification de certaines ambiguïté, ajout d'images traduites, plan encyclopédique. |
||
| Ligne 1 : | Ligne 1 : | ||
[[ |
[[File:FluorescentCells.jpg|vignette|upright=1.3|Cellulles endothéliales vues au microscope optique. En bleu, noyaux marqués au DAPI. En vert, microtubules marqués par un anticorps. En rouge, actine marquée à la phalloïdine.]] |
||
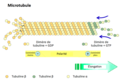
Le '''cytosquelette''' est un réseau de protéines dans le cytoplasme de toute cellule. Il regroupe des protéines polymérisées en fibre, des protéines de liaison, et des protéines motrices. Les trois principaux composants du cytosquelette sont les [[microfilament d'actine|microfilaments d'actine]], les [[filaments intermédiaires]], et les [[microtubule]]s. Le cytosquelette a un rôle structural puisqu'il est responsable de la forme de la cellule, de l'intégration de celle-ci dans un tissu, et du positionnement des organites, mais aussi dynamique puisqu'il est responsable des mouvements des organites dans la cellule et des mouvements de la cellule elle-même. |
|||
Les cytosquelettes des cellules [[eucaryote]]s sont assez similaires, bien qu'ils dépendent notamment de la spécialisation cellulaire. Les cytosquelettes des cellules [[procaryote]]s, récemment mis en évidence, semblent plus différents. |
|||
Le '''cytosquelette''' d'une [[Cellule (biologie)|cellule]] est l'ensemble organisé des [[polymère]]s biologiques qui lui confèrent l'essentiel de ses propriétés architecturales et mécaniques. La référence terminologique au « [[squelette]] » des vertébrés est cependant trompeuse puisque : |
|||
* la plupart des composantes du cytosquelette sont renouvelées par [[polymérisation]] en permanence ; |
|||
* le cytosquelette est à l'origine de la plupart des forces exercées par la cellule pour se déplacer et se nourrir, ce en quoi il s'apparente plutôt à un ensemble de « [[muscle]]s » ; |
|||
* les propriétés mécaniques du cytosquelette sont très variables suivant les composantes et les situations considérées ; |
|||
* l'activité du cytosquelette a des conséquences dépassant de loin les rôles purement mécaniques (mouvement et structure), par exemple : la régulation de l'expression génique, la [[différenciation cellulaire]] ou la prolifération. |
|||
== Structure == |
|||
Les cytosquelettes de tous les [[Eukaryota|eucaryotes]] sont assez similaires (bien que des différences importantes existent entre les cellules animales et végétales), tandis que ceux récemment découverts chez les [[Prokaryota|procaryotes]] semblent organisés de façon tout à fait différente. |
|||
=== Mise en évidence === |
|||
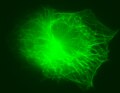
Le cytosquelette est observable par [[microscopie à fluorescence]]. On utilise pour cela une molécule se liant à l'actine, que l'on couple à un marqueur fluorescent ou fluorochrome. Pour les microfilaments d'actine, on peut utiliser la [[phalloïdine]] conjuguée à l'[[éosine]] (ils apparaitront rouge). Pour les microtubules, on peut utiliser des anticorps anti-tubuline associés à la [[fluorescéine]] (ils apparaitront vert). Les filaments intermédiaires ne sont pas visibles en microscopie optique avec des colorations standards. |
|||
=== Filaments d'actine === |
|||
== Cytosquelette des eucaryotes == |
|||
{{article détaillé|Filament d'actine}} |
|||
=== Composition et structure globale === |
|||
L'[[actine]] G globulaire se polymérise en actine F (filament d'actine), au niveau de l'extrémité + du microfilament tandis qu'il y a dépolymérisation au niveau de l'extrémité - du microfilament. L'actine est associé à de l'[[Adénosine triphosphate|ATP]] avant sa polymérisation, à de l'[[Adénosine diphosphate|ADP]] après sa dépolymérisation. On parle donc de filament polarisé. Un microfilament est une hélice de deux filaments d'actine F, un tour d'hélice correspond à treize actines. Un microfilament a un diamètre d'environ sept nanomètres et une longueur de persistance d'environ {{nombre|17 micromètres}}. Ces microfilaments sont très résistants mais leur capacité de déformation est très réduite. L'actine est associée à d'autres protéines (protéine de réticulation) comme la [[filamine]] et la fodrine, des protéines de poids moléculaire respectifs 250 et {{Unité|243 kDa}}, qui sont à l'origine du réseau tridimensionnel. Le résultat de ces associations est, entre autres, l'augmentation de la viscosité du cytosol. Le moteur moléculaire, ou protéine motrice, associé à ce type de filament est la [[myosine]]. |
|||
Le cytosquelette est constitué de polymères biologiques de protéines, qu'on qualifie parfois de fibres étant donné leur taille importante à l'échelle cellulaire. On les classe en trois catégories : |
|||
<gallery> |
|||
* les [[filament d'actine|filaments d'actine]], formés d'actine (protéine dont il existe différents types). On retrouve aussi ces mêmes filaments en grande quantité dans les [[Myocyte|fibres musculaires]]. Leur diamètre avoisine {{unité|7 à 8 nm}}, et leur [[longueur de persistance]] d'environ {{unité|17 µm}}. Ce sont donc des filaments assez flexibles, puisqu'ils sont disposés en double hélice. Ils sont également orientés, du fait de l'asymétrie des monomères d'actine et de leur assemblage en hélice : l'une des extrémités (+) peut polymériser beaucoup plus vite que l'autre (-). On parle de filaments polarisés. Les filaments d'actine forment un réseau dynamique. La dynamique des filaments d'actine est permise par un phénomène de tapis roulant (dépolymérisation à l'extrémité (-) et polymérisation à l'extrémité (+) et par le clivage des filaments par certaines protéines (raccourcissant de ce fait les filaments et multipliant par deux les sites (+) de polymérisation). |
|||
Fichier:Cytoskeleton - Actine filament -- Smart-Servier.png|Structure schématique d'un filament d'actine. |
|||
: L'actine est associée à d'autres protéines (protéine de réticulation) comme la [[filamine]] et la fodrine, soit des protéines se chiffrant à {{unité|250 et 243 kDa}} respectivement, qui sont à l'origine du réseau tridimensionnel. De surcroît, la fodrine peut être à l'origine de l'apparition de maladies auto-immunes où la production d'auto-anticorps ciblant cette protéine est extrapolée chez les individus souffrant de la maladie de Sjogren. Le résultat de ces associations est, entre autres, l'augmentation de la viscosité du cytosol et le déclenchement de certaines voies signalétiques. Les filaments d'actines sont composés du polymère d'actine F (filament) et du monomère d'actine G (globulaire). Il existe un équilibre dynamique entre l'actine F et l'actine G. Le réseau d'actine est situé sous la membrane plasmique, le degré de polymérisation définit la forme globale de la cellule et la plasticité de la cellule qui est nécessaire pour les processus de migration, d'endocytose, de division{{etc.}} ; |
|||
Fichier:Microfilament Structure-fr.svg|Constituants d'un filament d'actine. |
|||
* les [[filament intermédiaire|filaments intermédiaires]]. Ce sont les éléments les moins dynamiques du cytosquelette, mais leur étude se développe rapidement. Ils sont très importants pour la structure du [[Noyau (biologie)|noyau]] puisqu'ils sont les plus résistants. Eux sont non polarisés. Ils permettent l'ancrage des organites. Ils ont un diamètre pouvant se situer entre {{unité|8 et 10 nm}}, leur donnant ainsi une taille intermédiaire entre les microfilaments d'actine et les microtubules. On les trouve dans toutes les cellules [[eucaryotes]] mais pour certaines, on ne les trouve que chez les vertébrés. On distingue : |
|||
Fichier:Polymérisation de l'actine.jpg|Formation d'un filament d'actine. |
|||
** les filaments à kératine qui sont caractérisés par de nombreux [[pont disulfure|ponts disulfures]] ; on les trouve dans les cellules épidermiques des vertébrés, les cheveux, les poils, les ongles{{etc.}}, |
|||
Fichier:MEF microfilaments.jpg|Filaments d'actine dans des fibroblastes embryonnaires de souris, colorés à la phalloïdine. |
|||
** les filaments à desmine qu'on retrouve dans les cellules musculaires des muscles lisses, striés et dans le muscle cardiaque, |
|||
</gallery> |
|||
** la lamina nucléaire présente dans le noyau appliquée contre la membrane interne du noyau ; c'est une couche protéique fibrillaire dont les protéines sont des lamines ; |
|||
* les [[microtubule]]s sont les constituants les plus rigides du cytosquelette. Ce sont des structures cylindriques creuses dont la paroi est constituée de polymères de tubuline (dimères de tubuline α et β). Leur longueur de persistance est en effet de plusieurs millimètres, ce qui dépasse largement l'échelle de la cellule, pour un diamètre variant de {{unité|15 à 25 nm}} suivant les types de microtubules. Cette rigidité leur est conférée par une structure en tube due à l'assemblage particulier des monomères qui les composent. Les microtubules sont polarisés de la même façon que les filaments d'actine, mais la biochimie de polymérisation est différente. En particulier, il existe une instabilité dynamique qui peut conduire à un raccourcissement très brutal d'un microtubule, ce qui peut être à l'origine d'une force importante. |
|||
=== Filaments intermédiaires === |
|||
Les polymères sont organisés en réseaux, faisceaux ou câbles suivant les rôles qu'ils remplissent. Il est important de garder à l'esprit que la structure et la composition du cytosquelette sont hautement dynamiques. Ce haut niveau d'organisation et de labilité est rendu possible par la présence de centaines de protéines auxiliaires associées au cytosquelette : |
|||
{{article détaillé|filaments intermédiaires}} |
|||
* les protéines de pontage (couramment désignées par les termes anglais ''crosslinkers'' ou ''crosslinking proteins''). Ce terme fait référence à la physique des polymères, où l'ajout de certains composants (comme le soufre pour le caoutchouc) conduit à la formation de pontages entre les chaînes et modifie complètement les propriétés physiques du matériau. C'est effectivement ce qui se passe, de façon encore plus spectaculaire, dans le cas du cytosquelette. En effet, la plupart des ''crosslinkers'' sont contrôlés par la cellule au moyen d'autres protéines de régulation, ce qui permet des réorganisations parfois très rapides du cytosquelette ; |
|||
Les filaments intermédiaires se forment à partir de monomères, associés en dimères, eux-mêmes associés en tétramères. Ils ne sont pas polarisés et ont un diamètre d'une dizaine de nanomètres. Ils se déforment presque proportionnellement à la force exercée et le recouvrement important des dimères et des tétramères permet une très grande résistance aux contraintes mécaniques. On distingue les filaments intermédiaires de [[kératine]], caractérisés par de nombreux ponts disulfures ; les filaments intermédiaires de [[Lamine (biologie)|lamine]], constituant la [[lamina (biologie)|lamina]] au niveau du noyau ; et les filaments intermédiaires à desmine que l'on retrouve dans les cellules musculaires striées squelettiques et cardiaques et les cellules des muscles lisses. |
|||
* les protéines de branchement (parfois considérées comme un cas particulier des précédentes, mais importantes essentiellement dans le cas des filaments d'actine) ; |
|||
<gallery> |
|||
* les protéines capuchon et les protéines dépolymérisantes (''capping'', ''severing proteins'') qui régulent les taux de polymérisation des filaments à leurs extrémités ; |
|||
Fichier:Cytoskeleton - Intermediate filament -- Smart-Servier.png|Structure schématique d'un filament intermédiaire. |
|||
* les protéines d'ancrage ; |
|||
Fichier:Intermediate filament-fr.svg|Constituants d'un filament intermédiaire. |
|||
* les moteurs moléculaires, tels les myosines, les kinésines ou les dynéines. Vaste champ d'investigation de la biologie cellulaire, les moteurs moléculaires sont fondamentaux pour l'ajustement des propriétés mécaniques et morphologiques de la cellule ainsi que pour le trafic vésiculaire. |
|||
Fichier:Filamenti intermedi completo.jpg|Formation d'un filament intermédiaire. |
|||
Fichier:KeratinF9.png|Filaments intermédiaires de kératine dans des cellules embryonnaires. |
|||
</gallery> |
|||
=== Microtubules === |
|||
{{article détaillé|microtubule|centrosome}} |
|||
La forme de la cellule étant principalement définie par l'interaction pression osmotique/résistance de la paroi, on constate une moindre importance du cytosquelette : absence de filaments intermédiaires (sauf au niveau du noyau). |
|||
Les microtubules sont composés de treize protofilaments, eux-mêmes constitués de dimères de [[tubuline]] α et β. Comme pour les microfilaments, la polymérisation du microtubule s'effectue à son extrémité + tandis que la dépolymérisation s'effectue à son extrémité -. Il existe toutefois une exception lors des divisions cellulaires, lors desquelles il y a dépolymérisation à l'extrémité +. Les dimères de tubuline sont associés à du [[Guanosine triphosphate|GTP]] avant leur polymérisation, à du [[Guanosine diphosphate|GDP]] après leur dépolymérisation. Les microtubules ont un diamètre d'environ {{nombre|25 nanomètres}}, et leur longueur de persistance est de plusieurs millimètres, ce qui dépasse largement l'échelle de la cellule. Ils ont une capacité d'étirement importante mais une très faible résistance. Les moteurs moléculaires, ou protéines motrices, associés à ce type de filament sont la [[dynéine]], se déplaçant vers l'extrémité - du microtubule, et la [[kinésine]], se déplaçant vers l'extrémité + du microtubule. |
|||
Le réseau de microtubules est très développé et s'organise en une structure hélicoïdale se plaquant contre la membrane (liaison avec la synthèse des fibres de cellulose de la paroi). |
|||
<gallery> |
|||
En effet la synthèse des fibres de cellulose de la paroi végétale est orientée grâce à des microtubules corticaux le long de la membrane plasmique. |
|||
Fichier:Cytoskeleton - Microtubule -- Smart-Servier.png|Structure schématique d'un microtubule. |
|||
Fichier:Microtubule Structure-fr.svg|Constituants d'un microtubule. |
|||
Fichier:Microtúbulo. Dinamica-fr.png|Formation d'un microtubule. |
|||
Fichier:Retinal cell's microtubule network.tif|Microtubules dans une cellule rétinienne. |
|||
</gallery> |
|||
Les microtubules sont formés au niveau du [[centrosome|centre organisateur des microtubules]], souvent abrégé en COMT. Il regroupe deux centrioles, formant le centrosome, et du matériel péricentriolaire. Un centriole correspond à neuf triplets de microtubules. Les microtubules en formation sont implantés dans le centre organisateur des microtubules par leur extrémité +. |
|||
=== Structures localisées === |
|||
{{...}} |
|||
=== |
=== Assemblage, réseau === |
||
Les polymères sont organisés en réseaux, faisceaux ou câbles suivant les rôles qu'ils remplissent. Il est important de garder à l'esprit que la structure et la composition du cytosquelette sont hautement dynamiques. Ce haut niveau d'organisation et de labilité est rendu possible par la présence de centaines de protéines auxiliaires associées au cytosquelette : les protéines de pontage (couramment désignées par les termes anglais ''crosslinkers'' ou ''crosslinking proteins''), les protéines de branchement (parfois considérées comme un cas particulier des précédentes, mais importantes essentiellement dans le cas des filaments d'actine), les protéines capuchon et les protéines dépolymérisantes (''capping'', ''severing proteins''), les protéines d'ancrage, et les moteurs moléculaires évoqués précédemment. Les protéines de pontage permettent l'ajout de certains composants (comme le soufre pour le caoutchouc) et conduisent à la formation de pontages entre les chaînes et modifie complètement les propriétés physiques du matériau. Les protéines capuchon et les protéines dépolymérisantes qui régulent les taux de polymérisation des filaments à leurs extrémités. |
|||
Le cytosquelette contribue à de nombreuses fonctions au sein de la cellule : |
|||
* la régulation de la forme de la cellule (exemples : [[diapédèse]], sensibilité cellulaire aux paramètres mécaniques et topographiques du substrat environnant, matrice extracellulaire, autres cellules, biomatériaux...) ; |
|||
* l'ancrage aux membranes des cellules voisines ; |
|||
* la formation de protrusions ou d'involutions membranaires (importantes pour la [[phagocytose]] et pour la migration cellulaire : [[pseudopode]]s) ; |
|||
* le maintien de la structure interne, et en particulier des compartiments cellulaires ; |
|||
* le transport de protéines ou d'ARNm ; |
|||
* la séparation des chromosomes lors de la mitose ; |
|||
* la formation et la contraction de l'anneau mitotique permettant la séparation physique de deux cellules filles (cytodiérèse) ; |
|||
* la contraction des cellules musculaires. |
|||
La référence terminologique au « [[squelette]] » des vertébrés est cependant trompeuse puisque la plupart des composantes du cytosquelette sont renouvelées par polymérisation en permanence, les propriétés mécaniques du cytosquelette sont très variables suivant les composantes et les situations considérées, l'activité du cytosquelette a des conséquences dépassant les rôles purement mécaniques (par exemple : la régulation de l'expression génique, la différenciation cellulaire ou la prolifération). |
|||
Cette liste ne saurait être exhaustive, de nombreux rôles inconnus étant mis en évidence régulièrement par la recherche qui est très active dans ce domaine. |
|||
== Fonctions == |
|||
=== Propriétés mécaniques === |
|||
=== Rôle structural === |
|||
[[File:Cytosquelette type.png|thumb|Types de filaments du cytosquelette]] |
|||
[[Fichier:Human jejunum microvilli 2 - TEM.jpg|vignette|upright=0.8|Microvillosités d'entérocyte humain, observées au microscope électronique à transmission.]] |
|||
Les différents types de filaments ont des propriétés mécaniques très différentes : |
|||
[[Fichier:Desmosome cell junction fr.svg|vignette|upright=0.8|Desmosome.]] |
|||
* les [[Microtubule|microtubules]] ont une capacité d'étirement importante mais une très faible résistance ; |
|||
Dans les [[entérocyte]]s, les microfilaments d'actine sont responsables de l'architecture de la cellule avec notamment le soutien des [[microvillosité]]s, d'une hauteur de un micromètre. Dans les neurones, ce sont les microtubules qui assurent ce rôle architectural. |
|||
* les [[Filament d'actine|microfilaments d'actine]] sont très résistants mais leur capacité de déformation est très réduite ; |
|||
* les [[Filament intermédiaire|filaments intermédiaires]] se déforment presque proportionnellement à la force exercée et le recouvrement important des dimères et des tétramères permet une très grande résistance aux contraintes mécaniques. |
|||
La cohésion des tissus est assurée par le cytosquelette. Les ceintures d'adhérence et les points focaux (dont le rôle est important lors du développement embryonnaire) font intervenir des microfilaments d'actine, tandis que les [[desmosome]]s et [[hémidesmosome]]s font intervenir des filaments intermédiaires de kératine. Les ceintures d'adhérence et desmosomes permettent l'adhérence entre cellules avec l'intervention de protéines telles que les [[cadhérine]]s, reliées au cytosquelette par une protéine de liaison ou plaque protéique. Les hémidesmosomes et points focaux permettent l'adhérence de la cellule à la matrice extracellulaire avec l'intervention de protéines telles que les [[intégrine]]s, reliées elles aussi au cytosquelette par une protéine de liaison. Les cadhérines établissent des liaisons homophiliques calcium dépendante tandis que les intégrines établissent des liaisons hétérophiliques calcium dépendante, c'est-à-dire qu'elles nécessitent du calcium pour se réaliser. |
|||
== Cytosquelette des procaryotes == |
|||
La présence d'un cytosquelette a été mise en évidence chez les [[Prokaryota|procaryotes]] en 2006, grâce notamment aux travaux de [[Rut Carballido Lopez]]<ref>{{article| langue=en| titre=The Bacterial Actin-Like Cytoskeleton| auteur=Rut Carballido-López| périodique=Microbiology and Molecular Biology Reviews| doi=10.1128/MMBR.00014-06| jour=1| mois=décembre| année=2006| volume=70| numéro=4| pages=888-909}}</ref> et de son équipe. Ceux-ci ont découvert la protéine {{lien|langue=en|MreB}}, homologue à la protéine d'[[actine]], et de structure similaire, localisée sous la membrane et semblant jouer un rôle important dans la structure et la forme cellulaire. La protéine [[FtsZ]] jouerait également un rôle dans la [[cytodiérèse]] des bactéries. |
|||
Enfin, le rôle structural du cytosquelette se traduit par le positionnement des organites dans le noyau. En particulier, les filaments intermédiaire de lamine forment la [[lamina (biologie)|lamina]], responsable de la position et du maintien de l'enveloppe nucléaire. En effet, lors des divisions cellulaires notamment, la phosphorylation de ces filaments entraîne le disparition de l'enveloppe nucléaire. |
|||
=== Rôle dynamique === |
|||
[[Fichier:Kinetochore.jpg|vignette|upright=0.8|Microtubules lors d'une division cellulaire, en vert. L'ADN est en bleu.]] |
|||
[[Fichier:Sarcomere FR.svg|vignette|upright=0.8|Contraction musculaire.]] |
|||
Le rôle dynamique correspond aux mouvements de la cellule et dans la cellule. À titre d'exemple, lors du développement embryonnaire, les cellules [[mésoderme|mésodermiques]] se déplacent sur la matrice extracellulaire lors de la [[gastrulation]]. Ce déplacement fait intervenir les points focaux et les microfilaments d'actine qui, en se polymérisant, permettent la formation de [[lamellipode]]s. |
|||
Dans le cytoplasme, les microfilaments d'actine, associés à leur protéine motrice, la myosine, permettent le mouvement des organites, notamment des chloroplastes lors de la [[cyclose]]. L'actine et la myosine jouent également un rôle important dans la contraction musculaire puisque le raccourcissement des fibres musculaires et permis par le coulissage relatif des myofilaments entre eux. Les [[sarcomère]]s sont moins longs, ce qui se répercutent à l'échelle du muscle. Les microtubules, associés à la kinésine et la dynéine, permettent l'organisation du trafic vésiculaire. |
|||
Lors des divisions cellulaires, les microtubules kinétochoriens permettent la migration des chromosomes (lors de la [[méiose]]) ou des chromatides (lors de la [[mitose]]) vers les pôles opposés de la cellule. Ils s'y fixent en se polymérisant à leur extrémité + puis les font migrer en se dépolymérisant, toujours à l'extrémité +. Les microtubules polaires permettent l'allongement du fuseau mitotique avec l'intervention des protéines motrices. Il existe aussi des microtubules astériens, disposés en étoile autour des deux centres organisateurs des microtubules de la cellule en division. Les microfilaments d'actine interviennent en particulier lors de la [[cytodiérèse]], permettant la séparation du cytoplasme à l'issue de la télophase. |
|||
=== Autres rôles === |
|||
{{...}} |
|||
== Cas particuliers == |
|||
=== Cas des végétaux === |
|||
La forme de la cellule étant principalement définie par l'interaction pression hydrostatique/résistance de la [[paroi cellulaire|paroi]], on constate une moindre importance du cytosquelette : absence de filaments intermédiaires (sauf au niveau du noyau). Le réseau de microtubules est très développé et s'organise en une structure hélicoïdale se plaquant contre la membrane (liaison avec la synthèse des fibres de [[cellulose]] de la paroi). En effet la synthèse des fibres de cellulose de la paroi végétale est orientée grâce à des microtubules corticaux le long de la membrane plasmique. |
|||
=== Cas des procaryotes === |
|||
La présence d'un cytosquelette a été mise en évidence chez les [[procaryote]]s en 2006, grâce notamment aux travaux de [[Rut Carballido Lopez]] et de son équipe<ref>{{article| langue=en| titre=The Bacterial Actin-Like Cytoskeleton| auteur=Rut Carballido-López| périodique=Microbiology and Molecular Biology Reviews| doi=10.1128/MMBR.00014-06| jour=1| mois=décembre| année=2006| volume=70| numéro=4| pages=888-909}}</ref>. Ceux-ci ont découvert la protéine {{lien|langue=en|MreB}}, homologue à la protéine d'actine, et de structure similaire, localisée sous la membrane et semblant jouer un rôle important dans la structure et la forme cellulaire. La protéine [[FtsZ]] jouerait également un rôle dans la cytodiérèse des bactéries. |
|||
== Notes et références == |
== Notes et références == |
||
| Ligne 62 : | Ligne 78 : | ||
== Voir aussi == |
== Voir aussi == |
||
=== Bibliographie === |
|||
{{Autres projets| commons=Category:Cytoskeleton}} |
|||
* {{Ouvrage|auteur1=Raymond Julien|directeur1=oui|auteur2=Jean-Michel Petit|auteur3=Sébastien Arico|titre=Biologie cellulaire|éditeur=Dunod|date=2019|isbn=978-2-10-080401-6|isbn2=2-10-080401-4|oclc=1145890587|lire en ligne=https://www.worldcat.org/oclc/1145890587|consulté le=2023-05-06|plume=oui}} |
|||
=== Articles connexes === |
=== Articles connexes === |
||
* [[ |
* [[Filament d'actine]] |
||
* [[Filaments intermédiaires]] |
|||
* [[Microtubules]] |
|||
=== Liens externes === |
|||
* [[Centre organisateur des microtubules]] |
|||
* [http://www.ulysse.u-bordeaux.fr/atelier/ikramer/biocell_diffusion/gbb.cel.fa.104.b3/index.htm Ressource multimédia sur le cytosquelette (Univ. Bordeaux)] |
|||
{{Palette|Structures d'une cellule}} |
{{Palette|Structures d'une cellule}} |
||
{{Portail|biologie cellulaire et moléculaire}} |
{{Portail|biologie cellulaire et moléculaire}} |
||
[[Catégorie:Organite]] |
[[Catégorie:Organite]] |
||
Dernière version du 18 novembre 2023 à 15:11

Le cytosquelette est un réseau de protéines dans le cytoplasme de toute cellule. Il regroupe des protéines polymérisées en fibre, des protéines de liaison, et des protéines motrices. Les trois principaux composants du cytosquelette sont les microfilaments d'actine, les filaments intermédiaires, et les microtubules. Le cytosquelette a un rôle structural puisqu'il est responsable de la forme de la cellule, de l'intégration de celle-ci dans un tissu, et du positionnement des organites, mais aussi dynamique puisqu'il est responsable des mouvements des organites dans la cellule et des mouvements de la cellule elle-même.
Les cytosquelettes des cellules eucaryotes sont assez similaires, bien qu'ils dépendent notamment de la spécialisation cellulaire. Les cytosquelettes des cellules procaryotes, récemment mis en évidence, semblent plus différents.
Structure[modifier | modifier le code]
Mise en évidence[modifier | modifier le code]
Le cytosquelette est observable par microscopie à fluorescence. On utilise pour cela une molécule se liant à l'actine, que l'on couple à un marqueur fluorescent ou fluorochrome. Pour les microfilaments d'actine, on peut utiliser la phalloïdine conjuguée à l'éosine (ils apparaitront rouge). Pour les microtubules, on peut utiliser des anticorps anti-tubuline associés à la fluorescéine (ils apparaitront vert). Les filaments intermédiaires ne sont pas visibles en microscopie optique avec des colorations standards.
Filaments d'actine[modifier | modifier le code]
L'actine G globulaire se polymérise en actine F (filament d'actine), au niveau de l'extrémité + du microfilament tandis qu'il y a dépolymérisation au niveau de l'extrémité - du microfilament. L'actine est associé à de l'ATP avant sa polymérisation, à de l'ADP après sa dépolymérisation. On parle donc de filament polarisé. Un microfilament est une hélice de deux filaments d'actine F, un tour d'hélice correspond à treize actines. Un microfilament a un diamètre d'environ sept nanomètres et une longueur de persistance d'environ 17 micromètres. Ces microfilaments sont très résistants mais leur capacité de déformation est très réduite. L'actine est associée à d'autres protéines (protéine de réticulation) comme la filamine et la fodrine, des protéines de poids moléculaire respectifs 250 et 243 kDa, qui sont à l'origine du réseau tridimensionnel. Le résultat de ces associations est, entre autres, l'augmentation de la viscosité du cytosol. Le moteur moléculaire, ou protéine motrice, associé à ce type de filament est la myosine.
-
Structure schématique d'un filament d'actine.
-
Constituants d'un filament d'actine.
-
Formation d'un filament d'actine.
-
Filaments d'actine dans des fibroblastes embryonnaires de souris, colorés à la phalloïdine.
Filaments intermédiaires[modifier | modifier le code]
Les filaments intermédiaires se forment à partir de monomères, associés en dimères, eux-mêmes associés en tétramères. Ils ne sont pas polarisés et ont un diamètre d'une dizaine de nanomètres. Ils se déforment presque proportionnellement à la force exercée et le recouvrement important des dimères et des tétramères permet une très grande résistance aux contraintes mécaniques. On distingue les filaments intermédiaires de kératine, caractérisés par de nombreux ponts disulfures ; les filaments intermédiaires de lamine, constituant la lamina au niveau du noyau ; et les filaments intermédiaires à desmine que l'on retrouve dans les cellules musculaires striées squelettiques et cardiaques et les cellules des muscles lisses.
-
Structure schématique d'un filament intermédiaire.
-
Constituants d'un filament intermédiaire.
-
Formation d'un filament intermédiaire.
-
Filaments intermédiaires de kératine dans des cellules embryonnaires.
Microtubules[modifier | modifier le code]
Les microtubules sont composés de treize protofilaments, eux-mêmes constitués de dimères de tubuline α et β. Comme pour les microfilaments, la polymérisation du microtubule s'effectue à son extrémité + tandis que la dépolymérisation s'effectue à son extrémité -. Il existe toutefois une exception lors des divisions cellulaires, lors desquelles il y a dépolymérisation à l'extrémité +. Les dimères de tubuline sont associés à du GTP avant leur polymérisation, à du GDP après leur dépolymérisation. Les microtubules ont un diamètre d'environ 25 nanomètres, et leur longueur de persistance est de plusieurs millimètres, ce qui dépasse largement l'échelle de la cellule. Ils ont une capacité d'étirement importante mais une très faible résistance. Les moteurs moléculaires, ou protéines motrices, associés à ce type de filament sont la dynéine, se déplaçant vers l'extrémité - du microtubule, et la kinésine, se déplaçant vers l'extrémité + du microtubule.
-
Structure schématique d'un microtubule.
-
Constituants d'un microtubule.
-
Formation d'un microtubule.
-
Microtubules dans une cellule rétinienne.
Les microtubules sont formés au niveau du centre organisateur des microtubules, souvent abrégé en COMT. Il regroupe deux centrioles, formant le centrosome, et du matériel péricentriolaire. Un centriole correspond à neuf triplets de microtubules. Les microtubules en formation sont implantés dans le centre organisateur des microtubules par leur extrémité +.
Assemblage, réseau[modifier | modifier le code]
Les polymères sont organisés en réseaux, faisceaux ou câbles suivant les rôles qu'ils remplissent. Il est important de garder à l'esprit que la structure et la composition du cytosquelette sont hautement dynamiques. Ce haut niveau d'organisation et de labilité est rendu possible par la présence de centaines de protéines auxiliaires associées au cytosquelette : les protéines de pontage (couramment désignées par les termes anglais crosslinkers ou crosslinking proteins), les protéines de branchement (parfois considérées comme un cas particulier des précédentes, mais importantes essentiellement dans le cas des filaments d'actine), les protéines capuchon et les protéines dépolymérisantes (capping, severing proteins), les protéines d'ancrage, et les moteurs moléculaires évoqués précédemment. Les protéines de pontage permettent l'ajout de certains composants (comme le soufre pour le caoutchouc) et conduisent à la formation de pontages entre les chaînes et modifie complètement les propriétés physiques du matériau. Les protéines capuchon et les protéines dépolymérisantes qui régulent les taux de polymérisation des filaments à leurs extrémités.
La référence terminologique au « squelette » des vertébrés est cependant trompeuse puisque la plupart des composantes du cytosquelette sont renouvelées par polymérisation en permanence, les propriétés mécaniques du cytosquelette sont très variables suivant les composantes et les situations considérées, l'activité du cytosquelette a des conséquences dépassant les rôles purement mécaniques (par exemple : la régulation de l'expression génique, la différenciation cellulaire ou la prolifération).
Fonctions[modifier | modifier le code]
Rôle structural[modifier | modifier le code]


Dans les entérocytes, les microfilaments d'actine sont responsables de l'architecture de la cellule avec notamment le soutien des microvillosités, d'une hauteur de un micromètre. Dans les neurones, ce sont les microtubules qui assurent ce rôle architectural.
La cohésion des tissus est assurée par le cytosquelette. Les ceintures d'adhérence et les points focaux (dont le rôle est important lors du développement embryonnaire) font intervenir des microfilaments d'actine, tandis que les desmosomes et hémidesmosomes font intervenir des filaments intermédiaires de kératine. Les ceintures d'adhérence et desmosomes permettent l'adhérence entre cellules avec l'intervention de protéines telles que les cadhérines, reliées au cytosquelette par une protéine de liaison ou plaque protéique. Les hémidesmosomes et points focaux permettent l'adhérence de la cellule à la matrice extracellulaire avec l'intervention de protéines telles que les intégrines, reliées elles aussi au cytosquelette par une protéine de liaison. Les cadhérines établissent des liaisons homophiliques calcium dépendante tandis que les intégrines établissent des liaisons hétérophiliques calcium dépendante, c'est-à-dire qu'elles nécessitent du calcium pour se réaliser.
Enfin, le rôle structural du cytosquelette se traduit par le positionnement des organites dans le noyau. En particulier, les filaments intermédiaire de lamine forment la lamina, responsable de la position et du maintien de l'enveloppe nucléaire. En effet, lors des divisions cellulaires notamment, la phosphorylation de ces filaments entraîne le disparition de l'enveloppe nucléaire.
Rôle dynamique[modifier | modifier le code]


Le rôle dynamique correspond aux mouvements de la cellule et dans la cellule. À titre d'exemple, lors du développement embryonnaire, les cellules mésodermiques se déplacent sur la matrice extracellulaire lors de la gastrulation. Ce déplacement fait intervenir les points focaux et les microfilaments d'actine qui, en se polymérisant, permettent la formation de lamellipodes.
Dans le cytoplasme, les microfilaments d'actine, associés à leur protéine motrice, la myosine, permettent le mouvement des organites, notamment des chloroplastes lors de la cyclose. L'actine et la myosine jouent également un rôle important dans la contraction musculaire puisque le raccourcissement des fibres musculaires et permis par le coulissage relatif des myofilaments entre eux. Les sarcomères sont moins longs, ce qui se répercutent à l'échelle du muscle. Les microtubules, associés à la kinésine et la dynéine, permettent l'organisation du trafic vésiculaire.
Lors des divisions cellulaires, les microtubules kinétochoriens permettent la migration des chromosomes (lors de la méiose) ou des chromatides (lors de la mitose) vers les pôles opposés de la cellule. Ils s'y fixent en se polymérisant à leur extrémité + puis les font migrer en se dépolymérisant, toujours à l'extrémité +. Les microtubules polaires permettent l'allongement du fuseau mitotique avec l'intervention des protéines motrices. Il existe aussi des microtubules astériens, disposés en étoile autour des deux centres organisateurs des microtubules de la cellule en division. Les microfilaments d'actine interviennent en particulier lors de la cytodiérèse, permettant la séparation du cytoplasme à l'issue de la télophase.
Autres rôles[modifier | modifier le code]
Cas particuliers[modifier | modifier le code]
Cas des végétaux[modifier | modifier le code]
La forme de la cellule étant principalement définie par l'interaction pression hydrostatique/résistance de la paroi, on constate une moindre importance du cytosquelette : absence de filaments intermédiaires (sauf au niveau du noyau). Le réseau de microtubules est très développé et s'organise en une structure hélicoïdale se plaquant contre la membrane (liaison avec la synthèse des fibres de cellulose de la paroi). En effet la synthèse des fibres de cellulose de la paroi végétale est orientée grâce à des microtubules corticaux le long de la membrane plasmique.
Cas des procaryotes[modifier | modifier le code]
La présence d'un cytosquelette a été mise en évidence chez les procaryotes en 2006, grâce notamment aux travaux de Rut Carballido Lopez et de son équipe[1]. Ceux-ci ont découvert la protéine MreB (en), homologue à la protéine d'actine, et de structure similaire, localisée sous la membrane et semblant jouer un rôle important dans la structure et la forme cellulaire. La protéine FtsZ jouerait également un rôle dans la cytodiérèse des bactéries.
Notes et références[modifier | modifier le code]
- (en) Rut Carballido-López, « The Bacterial Actin-Like Cytoskeleton », Microbiology and Molecular Biology Reviews, vol. 70, no 4, , p. 888-909 (DOI 10.1128/MMBR.00014-06)
Voir aussi[modifier | modifier le code]
Bibliographie[modifier | modifier le code]
- Raymond Julien (dir.), Jean-Michel Petit et Sébastien Arico, Biologie cellulaire, Dunod, (ISBN 978-2-10-080401-6 et 2-10-080401-4, OCLC 1145890587, lire en ligne).