Hexachloroplatinate d'ammonium
| Hexachloroplatinate d'ammonium | |||
| |||
 | |||
| Identification | |||
|---|---|---|---|
| Nom UICPA | Hexachloroplatinate(IV) d'ammonium | ||
| Synonymes |
Chloroplatinate d'ammonium |
||
| No CAS | |||
| No ECHA | 100.037.233 | ||
| No CE | 240-973-0 | ||
| No RTECS | BP5425000 | ||
| PubChem | 16211460 | ||
| ChEBI | 59604 | ||
| SMILES | |||
| InChI | |||
| Apparence | poudre jaune[1] à orange[2] | ||
| Propriétés chimiques | |||
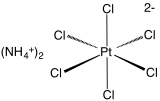
| Formule | (NH4)2PtCl6 | ||
| Masse molaire[3] | 443,879 ± 0,022 g/mol H 1,82 %, Cl 47,92 %, N 6,31 %, Pt 43,95 %, |
||
| Propriétés physiques | |||
| T° fusion | décomp. 380 °C[4] | ||
| Solubilité | 7 g·L-1 à 15 °C[1] | ||
| Masse volumique | 3,07 g·cm-3 à 25 °C[2] | ||
| Cristallographie | |||
| Classe cristalline ou groupe d’espace | Fm3m (no 225) |
||
| Propriétés optiques | |||
| Indice de réfraction | 1,8[4] | ||
| Précautions | |||
| SGH[1],[2],[4] | |||
| H301, H317, H318, H334, P261, P280, P301+P310, P305+P351+P338 et P342+P311 |
|||
| Transport[2] | |||
|
|||
| Écotoxicologie | |||
| DL50 | 195 mg·kg−1 (rat, oral)[1],[4] | ||
| Unités du SI et CNTP, sauf indication contraire. | |||
| modifier |
|||
L'hexachloroplatinate d'ammonium, également appelé chloroplatinate d'ammonium, est un hexachloroplatinate de formule (NH4)2[PtCl6]. Il s'agit d'un des rares exemples de sel de platine (IV) soluble qui n'est pas hygroscopique. Dans l'eau, il forme une solution jaune.
Préparation et structure[modifier | modifier le code]
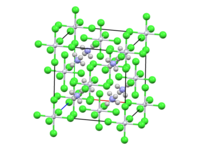
(NH4)2[PtCl6] est constitué de cations tétraédriques d'ammonium et d'anions octaédriques [PtCl6]2− séparés. Il est généralement synthétisé sous la forme d'un fin précipité jaune par réaction entre une solution d'acide hexachloroplatinique et une solution de sel d'ammonium[5],[6] :
- .
Ce complexe est si faiblement soluble qu'il est utilisé pour isoler le platine du minerai et des résidus recyclés[7],[8].
Analysé par cristallographie aux rayons X, le sel révèle une cristallisation en un motif cubique rappelant la structure de la fluorite. Il cristallise dans le groupe d'espace Fm3m (no 225)[6]. Les centres [PtCl6]2− sont octaédriques. Les centres NH4+ sont liés par liaison hydrogène aux ligands chlorures[9].
Utilisations et réactions[modifier | modifier le code]
L'hexachloroplatinate d'ammonium est utilisé pour le placage du platine. Le chauffage de (NH4)2[PtCl6] sous un courant d'hydrogène à 200 °C produit de l'éponge de platine. En réaction avec le chlore, cette éponge donne H2PtCl6[5].
Lorsque l'hexachloroplatinate d'ammonium est chauffé à haute température, il se décompose[1],[10] en plusieurs étapes[11], donnant globalement :
.
Il réagit avec l'acétate de cuivre(II) et le sulfure d'hydrogène, H2S pour donner des complexes cuivre-platine utilisés comme matériaux diamagnétiques et semi-conducteurs[2].
Notes et références[modifier | modifier le code]
- (en)/(de) Cet article est partiellement ou en totalité issu des articles intitulés en anglais « Ammonium hexachloroplatinate » (voir la liste des auteurs) et en allemand « Ammoniumhexachloroplatinat(IV) » (voir la liste des auteurs).
- Entrée « Ammonium hexachloroplatinate » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 01/02/2016 (JavaScript nécessaire)
- Fiche Sigma-Aldrich du composé Ammonium hexachloroplatinate(IV) 99.999% trace metals basis, consultée le 03/07/2016., [PDF] fiche MSDS.
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- PubChem CID 16211460
- (en) George B. Kauffman, « Ammonium Hexachloroplatinate(IV) », Inorganic Syntheses, vol. 9, , p. 182–185 (ISBN 978-0-470-13240-1, DOI 10.1002/9780470132401.ch51)
- (de) Georg Brauer, Handbuch der präparativen anorganischen Chemie 3., Band III. Enke, Stuttgart, 1981, p. 1712. (ISBN 3-432-87823-0).
- (en) S.A. Colton, Chemistry of precious metals, London New York, Blackie Academic & Professional, , 374 p. (ISBN 978-0-7514-0413-5, OCLC 807477289, lire en ligne).
- (en) Ysmael Verde-Gómez, Gabriel Alonso-Nuñez, Francisco Cervantes et Arturo Keer, « Aqueous solution reaction to synthesize ammonium hexachloroplatinate and its crystallographic and thermogravimetric characterization », ScienceDirect, (DOI 10.1016/S0167-577X(03)00381-1)
- Verde-Gómez, Y.; Alonso-Nuñez, G.; Cervantes, F.; Keer, A. "Aqueous solution reaction to synthesize ammonium hexachloroplatinate and its crystallogrpahic and thermogravimetric characterization" Materials Letters, 2003, volume 57, p. 4667-4672. DOI 10.1016/S0167-577X(03)00381-1
- Michael Moats, Venkoba Ramachandran, Timothy Robinson, W. G. Davenport, Extractive Metallurgy of Nickel, Cobalt and Platinum Group Metals, Elsevier, 2011, p. 509. (ISBN 0-08-096809-0), page sur googlebook.
- (en) Qingyu Kong, Francois Baudelet, Jun Han, Sebastien Chagnot, Laurent Barthe, Jon Headspith, Roger Goldsbrough, Frederic E. Picca et Olivier Spalla, « Microsecond time-resolved energy-dispersive EXAFS measurement and its application to film the thermolysis of(NH4)2[PtCl6] », Nature, (DOI 10.1038/srep01018, lire en ligne).








![{\displaystyle \mathrm {H_{2}[PtCl_{6}]+2\ NH_{4}Cl\longrightarrow (NH_{4})_{2}[PtCl_{6}]\downarrow +2\ HCl} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/f253dcda5f4a3d524e51dac17c76824b84571de5)
![{\displaystyle \mathrm {3\ (NH_{4})_{2}[PtCl_{6}]\ {\xrightarrow {1000\ ^{\circ }C}}\ 3\ Pt+2\ NH_{4}Cl+16\ HCl+2\ N_{2}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/9488e38bc226a222956879d1ffa5ad6bbe99632f)